

所属成套资源:全套苏教版(2019)高中化学必修第一册课时导学案
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学案设计
展开
这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学案设计,共13页。
课程目标
1.理解元素周期律的含义。
2.学会从不同角度分析元素性质的周期性变化。
3.学会元素周期律的实际应用。
图说考点
学业基础——自学·思记·尝试
[新知预习]
一、原子结构的变化规律
1.原子序数
(1)概念:按________由小到大的顺序给元素编号。
(2)数量关系:原子序数=________________=________________=________________。
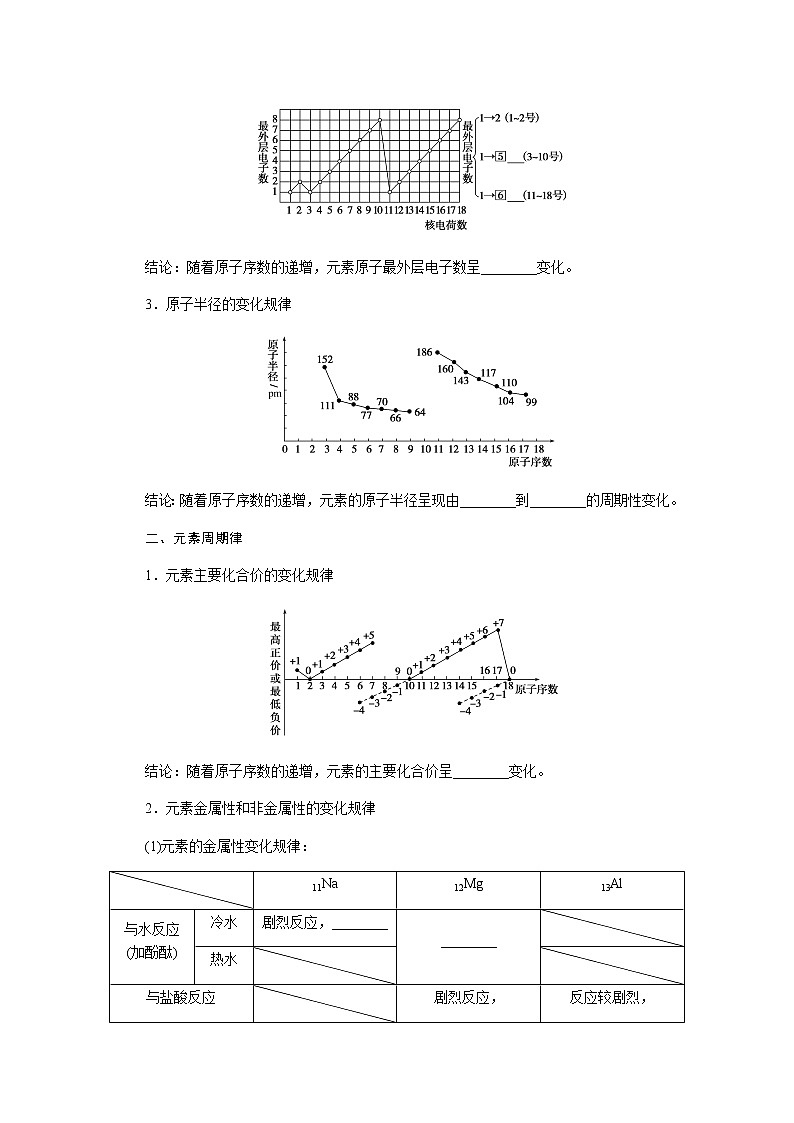
2.元素原子最外层电子数的变化规律
结论:随着原子序数的递增,元素原子最外层电子数呈________变化。
3.原子半径的变化规律
结论:随着原子序数的递增,元素的原子半径呈现由________到________的周期性变化。
二、元素周期律
1.元素主要化合价的变化规律
结论:随着原子序数的递增,元素的主要化合价呈________变化。
2.元素金属性和非金属性的变化规律
(1)元素的金属性变化规律:
①与水反应的剧烈程度: ______>______;
②与酸反应的剧烈程度: ______>______;
③最高价氧化物的水化物的碱性: ________>________>________;
结论:元素的金属性: ____________>____________>____________。
(2)元素的非金属性变化规律:
①单质与H2化合的难易程度(由难到易): _________________________________;
②气态氢化物的稳定性(由弱到强): ________;
③最高价氧化物的水化物酸性: _______________________________________;
结论:元素的非金属性: ________r(P)];
(2)层同看核(即核电荷数),核大半径小;
(3)核同看价(即化合价),价高半径小。
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
第1课时 元素周期律
学业基础
新知预习
核电荷数 核电荷数 质子数 核外电子数 8 8 周期性 大 小 eq \(□,\s\up1(10)) 周期性 eq \(□,\s\up1(11)) 溶液变红 eq \(□,\s\up1(12)) 无明显现象 eq \(□,\s\up1(13)) 有气泡,溶液微红 eq \(□,\s\up1(14)) 放出大量气泡 eq \(□,\s\up1(15)) 有气泡 eq \(□,\s\up1(16)) NaOH eq \(□,\s\up1(17)) Mg(OH)2 eq \(□,\s\up1(18)) Al(OH)3 eq \(□,\s\up1(19)) 强碱 eq \(□,\s\up1(20)) 中强碱 eq \(□,\s\up1(21)) Na eq \(□,\s\up1(22)) Mg eq \(□,\s\up1(23)) Mg eq \(□,\s\up1(24)) Al eq \(□,\s\up1(25)) NaOH
eq \(□,\s\up1(26)) Mg(OH)2 eq \(□,\s\up1(27)) Al(OH)3 eq \(□,\s\up1(28)) Na eq \(□,\s\up1(29)) Mg eq \(□,\s\up1(30)) Al eq \(□,\s\up1(31)) 光照或点燃 eq \(□,\s\up1(32)) SiH4 eq \(□,\s\up1(33)) PH3 eq \(□,\s\up1(34)) H2S eq \(□,\s\up1(35)) HCl eq \(□,\s\up1(36)) H2SiO3 eq \(□,\s\up1(37)) H3PO4 eq \(□,\s\up1(38)) H2SO4 eq \(□,\s\up1(39)) HClO4 eq \(□,\s\up1(40)) 弱酸 eq \(□,\s\up1(41)) 中强酸 eq \(□,\s\up1(42)) 强酸 eq \(□,\s\up1(43)) Si、P、S、Cl eq \(□,\s\up1(44)) SiH4
相关学案
这是一份苏教版 (2019)必修 第一册第三单元 从微观结构看物质的多样性学案,共11页。
这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物学案,共15页。
这是一份苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物学案设计,共13页。











