




所属成套资源:【高考引领教学】最新高考化学一轮针对性复习方案(全国通用)
第十一章 物质结构与性质章节检测(实战演练)-【高考引领教学】高考化学一轮针对性复习方案(全国通用)
展开
这是一份第十一章 物质结构与性质章节检测(实战演练)-【高考引领教学】高考化学一轮针对性复习方案(全国通用),文件包含第十一章物质结构与性质章节检测实战演练-高考引领教学高考化学一轮针对性复习方案全国通用解析版docx、第十一章物质结构与性质章节检测实战演练-高考引领教学高考化学一轮针对性复习方案全国通用原卷版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
第十一章 物质结构与性质章节检测
一、选择题(每小题只有一个正确选项,共14×3=42分)
1.( 2021年湖北省普通高中学业水平选择性考试)NA为阿伏加德罗常数的值。下列说法错误的是
A. 23gCH3CH2OH中sp3杂化的原子数为NA
B. 0.5molXeF4中氙的价层电子对数为3NA
C. 1mol[Cu(H2O)4]2+中配位键个数为4NA
D. 标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA
【答案】A
【解析】
A项:中C和O均为杂化,23g乙醇为0.5mol,杂化的原子数为,选项A错误;
B项:中氙的孤电子对数为,价层电子对数为,则中氙的价层电子对数为,选项B正确;
C项:1个中含有4个配位键,1mol含配位键的个数为,选项C正确;
D项:标准状况下。11.2LCO和的混合气体为0.5mol,分子数为,选项D正确。
答案选A。
2.(2022届江苏省如皋市高三上学期调研)X、Y、Z、W为前四周期原子序数依次增大的四种元素,X、Y、Z的原子半径和最外层电子数如右图所示。W的基态原子最外层只有1个电子且内层电子全部充满。下列说法正确的是( )。
A.第一电离能:X<Y
B.W的基态原子的电子排布式:1s22s22p63s23p64s1
C.Z元素没有正化合价
D.X的简单氢化物分子间能形成氢键
【答案】D
【解析】根据原子的最外层电子数和原子半径的相对大小,可以判断X、Y、Z分别为N、O、Cl,W的基态原子最外层只有1个电子且内层电子全部充满,说明其电子层排布为2,8,18,1,则W为29号元素Cu。
A项:由于N的核外电子排布为半满的稳定结构,第一电离能比O的大,即X>Y,A选项错误;
B项:Cu的基态原子的电子排布式:1s22s22p63s23p63p104s1,B选项错误;
C项:Cl元素有+1、+3、+5、+7等多种正价,C选项错误;
D项:X的简单氢化物为NH3,其分子间能形成氢键,D选项正确。
3.(2022届山东高考适应性训练)A、B、C、D四种短周期主族元素,原子序数依次增大。其中A原子和C原子最外层电子数相同,A与B、C与D基态原子的能层数相同。A的最高价氧化物对应水化物与其气态氢化物可以形成盐。A和B质子数之和等于D的质子数。下列比较中正确的是( )。
A.元素电负性:B>A>C>D
B.原子半径:B>A>C>D
C.第一电离能:B>A>C>D
D.A和D的最高价氧化物对应的水化物不都是强酸
【答案】C
【解析】A原子和C原子最外层电子数相同,A和C同主族;A与B、C与D基态原子的能层数相同,则A和B同周期,C和D同周期;A的最高价氧化物对应水化物与其气态氢化物可以形成盐,A为N元素,其质子数为7,C为P元素;A和B质子数之和等于D的质子数,D的质子数比B的质子数大7,若B为O元素,则D为P元素,不符合题意,则B为F元素,D为S元素。根据分析,A、B、C、D分别为N、F、P、S元素。
A项:元素的非金属性越强,电负性越强,非金属性F>N>S>P,则电负性B(F)>A(N)>D(S)>C(P),A错误;
B项:同周期元素原子半径从左到右逐渐减小,则原子半径:N>F,P>S;一般来说,电子层数越多,半径越大,则原子半径:S>N,综合原子半径:C(P)>D(S)>A(N)>B(F),B错误;
C项:同同期元素第一电离能随着原子序数增大而呈增大趋势,但第ⅡA族、第ⅤA元素第一电离能大于其相邻元素;同一主族元素第一电离能随着原子序数增大而减小,则第一电离能:B(F)>A(N)>C(P)>D(S),C正确;
D项:A和D的最高价氧化物的水化物分别为HNO3、H2SO4,均为强酸,D错误。
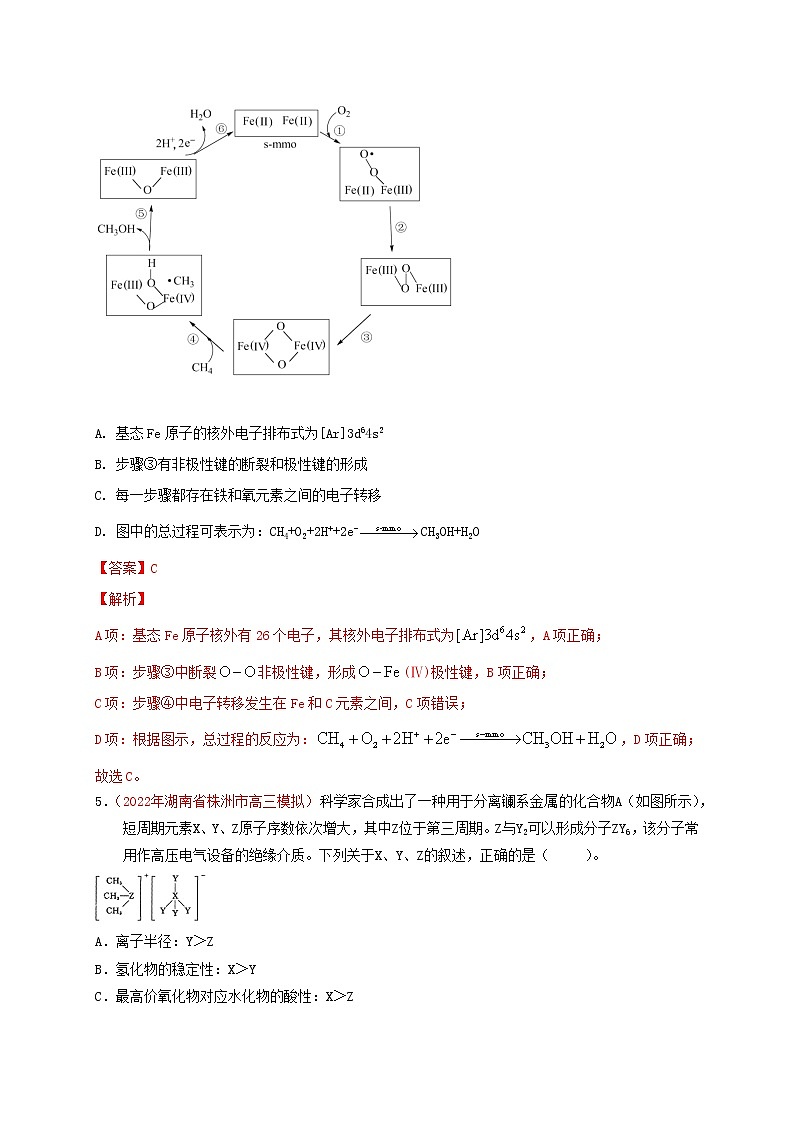
4. ( 2021年湖北省普通高中学业水平选择性考试)甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是
A. 基态Fe原子的核外电子排布式为[Ar]3d64s2
B. 步骤③有非极性键的断裂和极性键的形成
C. 每一步骤都存在铁和氧元素之间的电子转移
D. 图中的总过程可表示为:CH4+O2+2H++2e-CH3OH+H2O
【答案】C
【解析】
A项:基态Fe原子核外有26个电子,其核外电子排布式为,A项正确;
B项:步骤③中断裂非极性键,形成(Ⅳ)极性键,B项正确;
C项:步骤④中电子转移发生在Fe和C元素之间,C项错误;
D项:根据图示,总过程的反应为:,D项正确;
故选C。
5.(2022年湖南省株洲市高三模拟)科学家合成出了一种用于分离镧系金属的化合物A(如图所示),短周期元素X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y2可以形成分子ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述,正确的是( )。
A.离子半径:Y>Z
B.氢化物的稳定性:X>Y
C.最高价氧化物对应水化物的酸性:X>Z
D.化合物A中,中心原子X、Z均为sp3杂化
【答案】D
【解析】短周期元素X、Y、Z原子序数依次增大,观察负离子结构为,Y成一个共价键,为-1价,不是第三周期元素,且原子序数大于X,应为F元素又因为Z与Y2可以形成分子ZY6,且Z位于第三周期,所以Z为S元素;X得到一个电子成4个共价键,说明其最外层为3个电子,为B元素,据此分析解答。
A项:电子层数F−<S2−,离子半径F−<S2−,所以Z>Y,A错误;
B项:项:非金属性越强,简单氢化物越稳定,非金属性:F>B,则有BH3<HF,所以X<Y,B错误;
C项:非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:S>B,则酸性H3BO3(弱酸)<H2SO4(强酸),所以X<Z,C错误;
D项:根据上述分析可知,化合物A中,中心原子X、Z均为sp3杂化,D正确。
6. (2021年山东省高考试题)关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是
A. CH3OH为极性分子 B. N2H4空间结构为平面形
C. N2H4的沸点高于(CH3)2NNH2 D. CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
【答案】B
【解析】
A项:甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,A正确;
B项:N2H4中N原子的杂化方式为sp3,不是平面形,B错误;
C项:N2H4分子中连接N原子的H原子数多,存在氢键的数目多,而偏二甲肼((CH3)2NNH2)只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点较N2H4的低,C正确;
D项:CH3OH为四面体结构,-OH结构类似于水的结构,(CH3)2NNH2的结构简式为,两者分子中C、O、N杂化方式均为sp3,D正确;
故选B。
7.(2021届辽宁省丹东市高三一模)LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20,下列说法正确的是( )。
A.四种元素形成的简单氢化物中Z的沸点最高
B.原子半径:Z>Y>X>W
C.X的杂化方式是sp3
D.电负性:Z>Y>X>W
【答案】D
【解析】根据图示可知,X形成四个共价键,Y形成两个共价键,结合“Y的最外层电子数等于X的核外电子总数”,则可以X是碳,Y是氧;Z形成一个共价键,结合“同周期元素原子W、X、Y、Z”,则Z是氟;因为“四种原子最外层电子数之和为20”,则W的最外层电子数为20―4―6―7=3,则W是硼。
A项:四种元素形成的简单氢化物中H2O的沸点最高,即Y元素的简单氢化物中沸点最高,A选项错误;
B项:同周期元素,原子序数越大,原子半径越小,则原子半径B(W)>C(X)>O(Y)>F(Z),B选项错误;
C项:LDFCB中的碳全部是双键碳,为sp2杂化,C选项错误;
D项:非金属性越强,元素原子的电负性越大,则电负性F(Z)>O(Y)>C(X)>B(W),D选项正确。
8.(2022届湖北省七市(州)教科研协作体高三联考)元素X的基态原子的2p能级有4个电子;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。下列推断正确的是( )。
A.Y是S元素,基态原子最外层电子排布图为
B.离子晶体ZX、ZY的熔点:ZX>ZY
C.在Y的氢化物H2Y分子中,Y原子轨道的杂化类型是sp2
D.Y与X可形成YX32-,立体构型为四面体
【答案】B
【解析】元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子,Z是Zn元素;元素X的基态原子的2p能级有4个电子,X是O元素;元素Y的M层电子运动状态与X的价电子运动状态相同,Y是S元素。
A项:S元素基态原子最外层电子排布图为,A错误;
B项:离子晶体中离子的半径越小,带电荷数越多,晶格能越大,晶体的熔沸点越高,可知熔点ZnO>ZnS,B正确
C项:H2S分子中,S原子杂化轨道数是4,S原子轨道的杂化类型是sp3,C错误;
D项:SO32-中S原子的价层电子对数是4,含有一对孤对电子,所以立体构型为三角锥形,D错误。
9.(2022届天津市河西区高三模拟)X、Y、Z、W是原子序数依次增大的不同主族的短周期元素。X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10。下列说法正确的是( )。
A.简单氢化物的热稳定性:Z>W>X
B.Z、W的简单气态氢化物中心原子的杂化方式不相同
C.XW2分子的空间构型为直线形
D.Z的最高价含氧酸的钠盐溶液中有三种含Z元素的微粒
【答案】C
【解析】短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族,X的最高正价与最低负价代数和为0,X与W所在族序数之和等于10,则X处于ⅣA族,W处于ⅥA族,结合原子序数可知,X为C元素、W为S元素,Y与Z最外层电子数之和与W的最外层电子数相等,即二者最外层电子数之和为6,又由于分别位于不同的主族,只能为ⅠA、ⅤA族元素,结合原子序数,则Y为Na元素、Z为P元素。X为C元素、W为S元素,Z为P元素;
A项:非金属性越强,其简单气态氢化物的稳定性越强,非金属性W>Z,简单气态氢化物的热稳定性:W>Z,故A错误;
B项:W为S元素,Z为P元素,Z、W的简单气态氢化物分别为PH3和H2S,PH3中心原子P的价电子对数=3+=4,P原子的杂化方式为sp3杂化,H2S中心原子S的价电子对数=2+=4,S原子的杂化方式为sp3杂化,二者中心原子的杂化方式相同,故B错误;
C项:X为C元素、W为S元素,XW2为CS2,CS2与CO2互为等电子体,互为等电子体的分子具有相似的结构,CO2分子的空间构型为直线形,则CS2分子的空间构型也为直线形,故C正确;
D项:Z为P元素,Z的最高价含氧酸的钠盐溶液为Na3PO4,Na3PO4属于强碱弱酸盐,PO43-在溶液中发生多步水解,在溶液中以PO43-、HPO42-、H2PO4-、H3PO4四种含P元素的微粒存在,故D错误。
10.(2022·阜新市高级中学高三二模)铁有δ、γ、α三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是
A.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个
C.δ-Fe晶胞中Fe原子数与α-Fe晶胞中Fe原子数之比为2:1
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体相同
【答案】D
【解析】A项:由题图知,δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个,A项正确;
B项:α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个,B项正确;
C项:根据均摊法原则可知δ-Fe晶体中铁原子个数是1+=2,α-Fe晶胞中Fe原子数是=1,则δ-Fe晶胞中Fe原子数与α-Fe晶胞中Fe原子数之比为2:1,C项正确;
D项:将铁加热后急速冷却和缓慢冷却,得到的晶体不同,D项错误。
综上所述,本题正确答案为D。
11.(2021·山东潍坊市·高三三模)Cu2ZnSnS4是太阳能薄膜电池的重要成分,其晶胞结构(棱边夹角均为90°)如图所示,下列说法错误的是
A.第一电离能:Cu
相关试卷
这是一份第十一章 物质结构与性质章节检测(实战演练)-【高考引领教学】2023届高考化学一轮针对性复习方案(全国通用)(原卷版),共10页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份专题解密(二) 化学计算 专题检测(实战演练)-【高考引领教学】高考化学一轮针对性复习方案(全国通用),文件包含专题解密二化学计算专题检测实战演练-高考引领教学高考化学一轮针对性复习方案全国通用解析版docx、专题解密二化学计算专题检测实战演练-高考引领教学高考化学一轮针对性复习方案全国通用原卷版docx等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
这是一份第一节 物质的组成、性质和分类 (实战演练)-【高考引领教学】高考化学一轮针对性复习方案(全国通用),文件包含第一节物质的组成性质和分类实战演练解析版-高考引领教学高考化学一轮针对性复习方案全国通用docx、第一节物质的组成性质和分类实战演练原卷版-高考引领教学高考化学一轮针对性复习方案全国通用docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。








