

山东省济宁市兖州区2022-2023学年高二上学期期中考试化学试题
展开2022—2023学年第一学期期中质量检测
高二化学试题
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cu 64
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.从科技前沿到日常生活,化学无处不在。下列说法错误的是( )
A.我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程
B.神舟十三号升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂转化为
C.明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同
D.溶液可作焊接金属的除锈剂
2.向水中加入少量下列物质或改变下列条件,能促进水的电离,且溶液中的是( )
A.固体 B.将水加热煮沸 C.NaClO固体 D.氨气
3.已知某容器中存在反应 ,。下列说法错误的是( )
A.保持恒容,向容器中充入,各种物质物质的量浓度均增大
B.保持恒温,增大压强,物质的量浓度减小
C.保持恒容,降低温度,气体的平均相对分子质量变大
D.当容器内颜色不再变化时,两反应均达到平衡状态
4.下列说法正确的是( )
A.若反应在常温下能自发进行,则该反应的
B.强电解质溶液的导电能力一定比弱电解质溶液强
C.其他条件不变,升高温度,一定增大活化分子百分数,但不一定加快反应速率
D.配制溶液时,为了加快溶解,可在热水中溶解再冷却
5.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解:。能判断该反应已经达到化学平衡的是( )
①②密闭容器中总压强不变③密闭容器中混合气体的密度不变④密闭容器中混合气体的平均相对分子质量不变⑤密闭容器混合气体的总物质的量不变⑥密闭容器中的体积分数不变⑦混合气体总质量不变
A.①②③⑤⑦ B.①②⑤⑦ C.①⑤⑥ D.全部
6.25°C时部分电解质的电离平衡常数数据如下。
HClO | |||
已知,。下列说法错误的是( )
A.NaHR溶液中既存在的电离也存在的水解
B.等浓度溶液的pH:
C.向NaClO溶液中通入少量,漂白性增强的原因是
D.等浓度的NaClO和混合溶液中存在
7.液氨与水相似,存在着微弱的电离:在―50℃时,两种离子的平衡浓度均为,下列有关液氨的离子积及其电离平衡的叙述中错误的是( )
A.此温度下,液氨的离子积等于
B.在液氨中加入,则液氨中将大于
C.此温度下,在液氨中加入,则液氨中
D.在液氨中放入,则液氨的离子积数值将增大
8.已知:①的燃烧热为;
② ;
③中和热为下列热化学方程式书写正确的是( )
A.
B.
C.
D.
9.在一定温度下发生反应: ,在密闭容器中达平衡后,改变下列条件达到新平衡后可使混合气体颜色加深的是( )
A.保持容器容积不变,充入氮气 B.保持温度压强不变,充入
C.降温 D.缩小容器的容积
10.已知常温下,,下列有关说法不正确的是( )
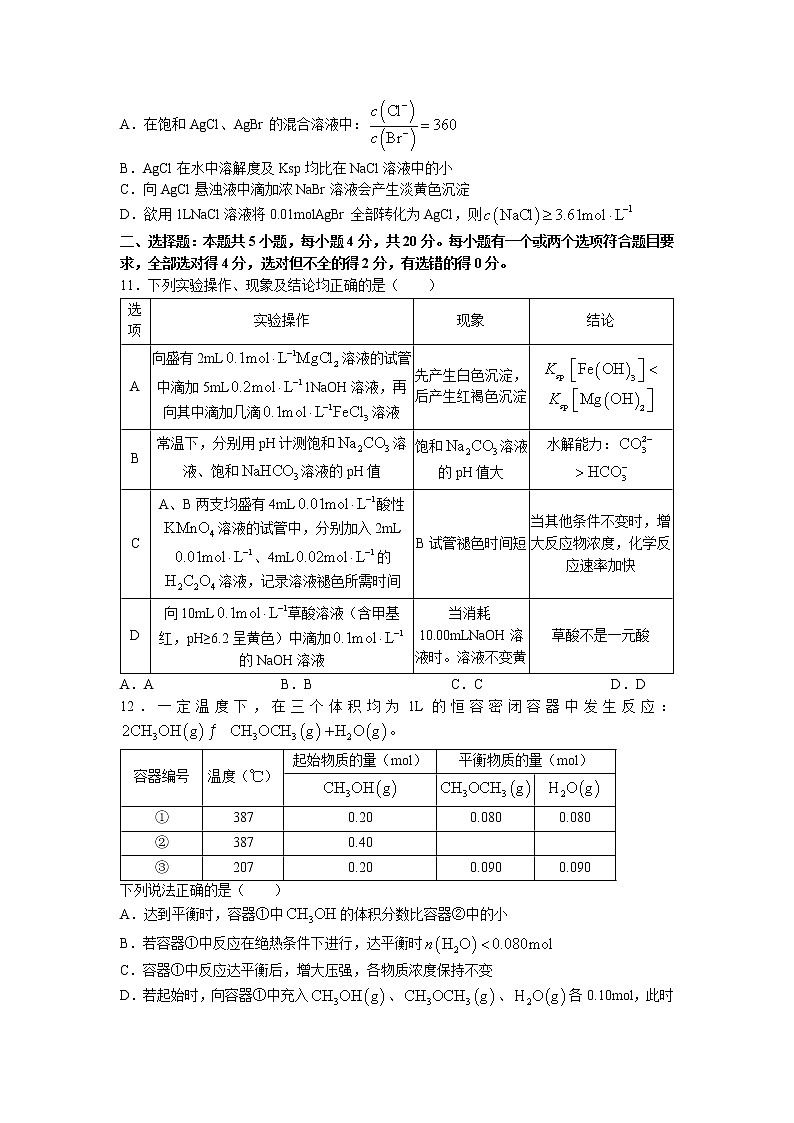
A.在饱和AgCl、AgBr的混合溶液中:
B.AgCl在水中溶解度及Ksp均比在NaCl溶液中的小
C.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
D.欲用1LNaCl溶液将0.01molAgBr全部转化为AgCl,则
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验操作、现象及结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有2mL溶液的试管中滴加5mL1NaOH溶液,再向其中滴加几滴溶液 | 先产生白色沉淀,后产生红褐色沉淀 | |
B | 常温下,分别用pH计测饱和溶液、饱和溶液的pH值 | 饱和溶液的pH值大 | 水解能力: |
C | A、B两支均盛有4mL酸性溶液的试管中,分别加入2mL、4mL的溶液,记录溶液褪色所需时间 | B试管褪色时间短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
D | 向10mL草酸溶液(含甲基红,pH≥6.2呈黄色)中滴加的NaOH溶液 | 当消耗10.00mLNaOH溶液时。溶液不变黄 | 草酸不是一元酸 |
A.A B.B C.C D.D
12.一定温度下,在三个体积均为1L的恒容密闭容器中发生反应:。
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
① | 387 | 0.20 | 0.080 | 0.080 |
② | 387 | 0.40 |
|
|
③ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.达到平衡时,容器①中的体积分数比容器②中的小
B.若容器①中反应在绝热条件下进行,达平衡时
C.容器①中反应达平衡后,增大压强,各物质浓度保持不变
D.若起始时,向容器①中充入、、各0.10mol,此时反应正向进行
13.常温下向100mL的氨水中逐滴加入的盐酸,所得溶液的pH、溶液中和的物质的量分数与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是( )
A.表示物质的量分数变化的曲线是B
B.pH=9.26时溶液中,的电离程度小于的水解程度
C.常温下的电离常数为(已知lg1.8=0.26)
D.当加入盐酸体积为50mL时,溶液中
14.向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[阶段未画出]。图乙为改变条件平衡体系中化学反应速率随时间变化的情况,、、、时刻均改变一种条件,且改变的条件均不同。已知时刻为使用催化剂。下列说法正确的是( )
A.B的起始物质的量为0.02mol
B.若,生成物C在段的化学反应速率为
C.时刻改变的条件可能为降温
D.时刻改变的条件可能为充入0.1molB
15.叠氮酸()是一种弱酸。常温下,向20mL的溶液中逐滴加入溶液。测得滴定过程电溶液的pH随变化如图所示,下列说法正确的是( )
A.点①溶液中:
B.点②溶液中:
C.常温下,的数量级为
D.点③溶液中:
三、非选择题:本题共5小题,共60分
16.(12分)某小组利用溶液与用硫酸酸化的溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀并开始计时。该小组设计了如下方案:
编号 | 溶液 | 溶液 | 蒸馏水体积/mL | 温度/℃ | ||
浓度/ | 体积/mL | 浓度/ | 体积/mL | |||
① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
② | 0.50 | 3.0 | 0.010 | 4.0 | a | 25 |
③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(1)该探究实验判断反应快慢需测量的物理量是:______。
(2)实验①反应用时20s,忽略混合前后溶液体积的微小变化,这段时间内反应速率______。
(3)已知被()氧化为逸出,该反应的离子方程式为______,为了观察到实验现象从而判断反应的快慢,与初始的物质的量的比值需要满足的关系为______。
(4)探究温度对化学反应速率影响的实验编号是______(填编号);欲通过实验编号①②探究,浓度对化学反应速率影响,则a=______。
(5)该小组通过分析室温下反应速率走势(如图),认为时间内速率变快除反应放热温度升高外还有其他原因,若想验证这一原因,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择最合理的试剂是______(填字母)。
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
17.(12分)汽车尾气中主要污染物是和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发和反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是______,图1中对应反应的热化学方程式为______。
(2)和CO均是有害气体,可在表面转化为无害气体,其反应原理如下: 。有关化学反应的能量变化过程如图2所示。
①图2中反应是______(填“放热”或“吸热”)反应,该反应的活化能为______,该反应的______。
②加入作为该反应的催化剂,则______(填“增大”“减小”或“不变”,下同),______。
(3)利用还原法可将,还原为进行脱除。已知:,若有0.5molNO被还原,放出的热量为______。
18.(12分)CO可用于合成甲醇,化学方程式为:。
(1)图1是反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变______(填“>”“<”或“=”)0。
②和温度下的平衡常数大小关系是______(填“>”“<”或“=”)。
在温度下,往体积为1L的密闭容器中,充入1molCO和2mol,经测得CO和的浓度随时间变化如图2所示。则该反应的平衡常数为______。
③若容器容积不变,下列措施可增加CO转化率的是______(填字母)。
a.升高温度 b.将从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线z对应的温度是______℃;该温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为、、,则、、的大小关系为______。
19.(13分)酸碱中和滴定法与氧化还原滴定法均为重要的定量分析法,应用广泛。回答下列问题:
Ⅰ.酸碱中和滴定
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
已知:国家标准规定酿造白醋中醋酸含量不得低于。
(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后______。
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为______mL。
③已知实验所用标准NaOH溶液的浓度为,根据上述滴定结果可知该白醋______(填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是______(填编号)。
a.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
b.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
c.滴定过程中摇动锥形瓶时有液滴溅出
d.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
e.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用NaOH溶液分别滴定体积均为20.00mL、浓度均为的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是______(填“Ⅰ”或“Ⅱ”)。
②和的关系:______(填“>”“=”或“<”)。
③若25℃时,的醋酸与的氢氧化钠溶液等体积混合后溶液为中性,则醋酸的电离常数为______(用含a的代数式表示)。
Ⅱ.氧化还原滴定
(3)的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
。步骤如下:
①称取1.250g胆矾产品配成100mL溶液;
②取其中25.00mL溶液,滴加KI溶液至不再产生沉淀;
③用标准溶液滴定,平行滴定3次。
若标准溶液的平均用量为10.00mL,则胆矾产品纯度为______%。
20.(11分)(重铬酸钾)是一种重要的化工试剂。工业上以铬铁矿(主要成分是)为原料制备,的流程如下:
(1)“水浸”过程需要适当加热,其目的是______。
(2)常温下,铬酸的电离常数:,,溶液呈碱性的原因______。(用离子方程式表示),溶液中______。
(3)“转化1”中生成的离子方程式为______。
(4)以形式标准溶液滴定溶液中的时,采用为指示剂,利用与反应生成砖红色沉淀指示滴定终点。当溶液中的恰好沉淀完全(浓度等于)时,溶液中______,______。(已知25℃时、的分别为,)
2022—2023学年度第一学期期中考试
高二化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1. C 2. C 3.B 4.A 5.A 6. A 7. D 8.C 9.D 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. D 12. BD 13. C 14. B 15.AD
16.(12分)
(1)KMnO4溶液褪色时间(2分) (2)2 ×10-4mol· L-1·s-1(2分)
(3)2MnO4-+5H2C2O4+6H+= 2Mn2+ +10CO2↑+8H2O (2分) (2分)
(4)①③ (1分) 3. 0 (1分) (5)B (2分)
17.(12分)
(1) N2 (1分) N2(g)+ O2(g)=2NO(g) ΔH=+180 kJ·mol-1 (2分)
(2) ① 放热 (1分) 134 kJ·mol-1 (2分) -226 kJ·mol-1 (2分)
② 减小(1分) 不变 (1分)
(3) 172.5 kJ (2分)
18. (12分)
(1)①. < (1分) ②. > (1分) 12 (2分) ③ b (2分)
(2)270(2分) 4 (2分) K1=K2<K3(2分)
19.(13分)
(1) ①溶液由无色变为浅红色,且在半分钟内不褪色 (1分)
② 26.10 (1分) ③符合(2分) ④ cd(2分)
(2) ① I (1分) ② <(2分) ③ (2分)
(3)80.00%(2分)
20.(11分)
(1)提高水浸速率 (1分)
(2) (2分) (2分)
(3) (2分)
(4) (2分) (2分)
山东省济宁市兖州区2023-2024学年高一上学期期中考试化学试题: 这是一份山东省济宁市兖州区2023-2024学年高一上学期期中考试化学试题,共9页。试卷主要包含了下列物质中含有自由移动的的是,下列说法正确的是,下列离子方程式书写正确的是,下列物质的分类正确的是等内容,欢迎下载使用。
山东省济宁市兖州区2023-2024学年高三上学期期中考试化学试题: 这是一份山东省济宁市兖州区2023-2024学年高三上学期期中考试化学试题,共11页。试卷主要包含了5 Fe 56 Cu 64,反应应用于玻璃雕刻,碳量子点等内容,欢迎下载使用。
山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题: 这是一份山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题,共11页。试卷主要包含了过渡态理论认为等内容,欢迎下载使用。












