



高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优秀ppt课件
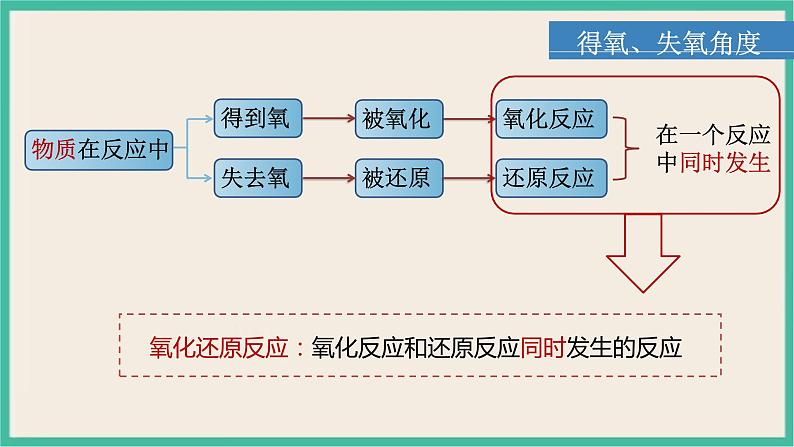
展开氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
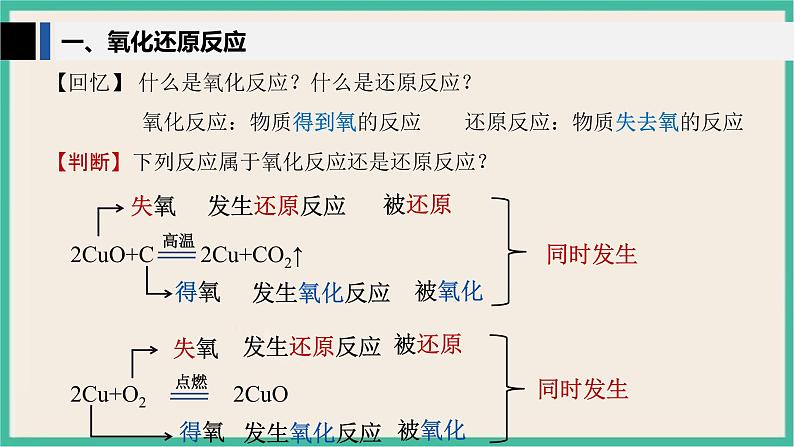
【回忆】 什么是氧化反应?什么是还原反应?
【判断】下列反应属于氧化反应还是还原反应?
判断:下列反应哪些属于氧化还原反应?Cu+O2 === 2 CuOC + 2 CuO === 2Cu + CO2 ↑Fe + CuSO4 === FeSO4 + Cu2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4H2+CuO Cu + H2O
请认真观察铜元素反应前后的变化,找出其中的规律。
你找出了哪些规律?Cu+O2 === 2 CuOC + 2 CuO === CO2 + 2 CuFe + CuSO4 === FeSO4 + Cu2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4H2+CuO Cu + H2O
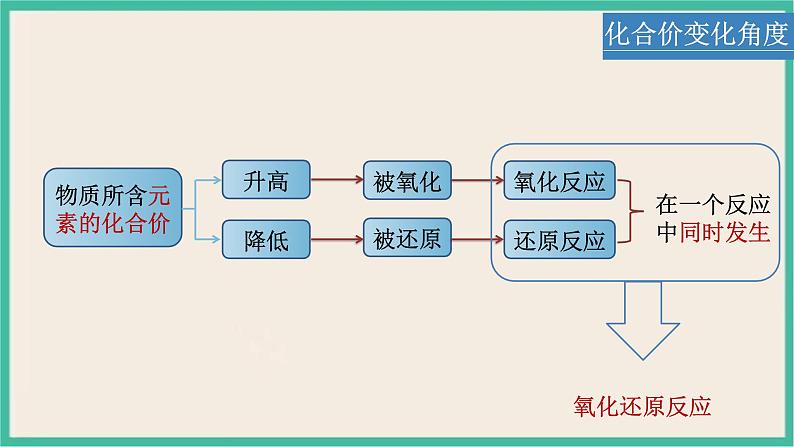
1.氧化还原反应前后,有的元素化合价升高2.氧化还原反应前后,有的元素化合价降低3.氧化还原反应前后,有的元素化合价不变
氧化还原反应的重要特征:反应前后,有元素化合价变化
化合价升高总数=化合价降低总数
4.反应前后,所有元素化合价都没有变化的反应不是氧化还原反应
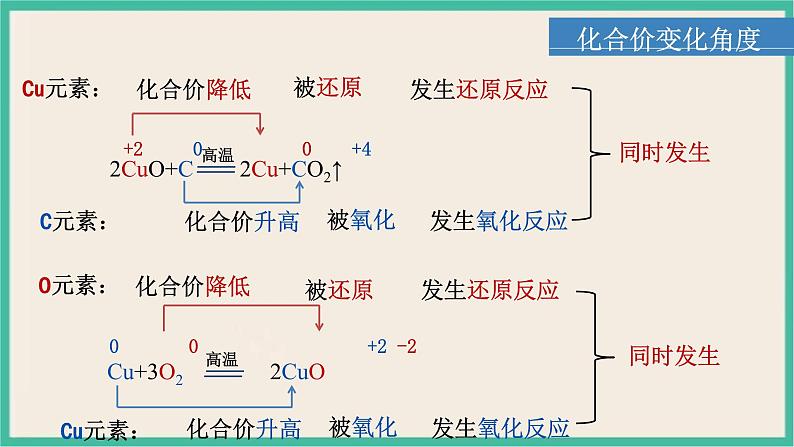
+2 0 0 +4
0 0 +2 -2
一价钾钠氢氯银,二价氧钙钡镁锌,三铝四硅五价磷,可变价态也不难,二三铁,二四碳,二四六硫都齐全,铜汞二价最常见,莫忘单质价为零。
(1)CuO Cu2O Fe2O3 Na2O CaCO3 CO FeO(2)KMnO4 K2MnO4 MnO2 MnCl2(3)Cl2 HCl KCl KClO3 NaClO(4)H2S SO2 H2SO3 H2SO4 H2O2 H2O(5)NH3 N2O NO NO2 NH4NO3
以Na与Cl2反应为例
2 Na+ Cl2 === 2 NaCl
化合价升高,被氧化 氧化反应
0 0 +1 -1
化合价降低,被还原 还原反应
以H2与Cl2反应为例
0 0 +1 -1
H和Cl都不易失去电子,都可获得1个电子形成稳定的结构,二者只能形成共用电子对,使双方最外层都达到稳定结构。
氧化还原反应的本质:氧化还原反应中一定有电子的转移(得失或偏移)
电子的转移(电子得失或偏移)
氧化还原反应的判断方法
氧化还原反应的认识发展
对氧化还原反应的认识角度
根据反应物和生成物的类别以及反应前后物质的种类的多少
AB+CD=AD+CB
CaO+H2O=Ca(OH)2
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
氧化还原反应与四种基本反应类型有什么关联?
人教版 (2019)第三节 氧化还原反应优秀课件ppt: 这是一份人教版 (2019)第三节 氧化还原反应优秀课件ppt,共42页。PPT课件主要包含了还原性,二重性,问题解决,你学会了吗,氧化性,回顾练习,氧化还原反应,学习目标,只有氧化性,既有氧化性又有还原性等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应完美版课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应完美版课件ppt,共60页。PPT课件主要包含了反应特征,反应本质,认识概念,电子转移,氧化剂,还原剂,还原产物,氧化产物,化合价升高,被氧化等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优秀ppt课件,共19页。PPT课件主要包含了氧化还原反应规律,标变价,化合价升降数目相等,电荷守恒,c缺项配平,H2O,↑6x+2,x=5,根据化学式找变化,价态规律等内容,欢迎下载使用。












