




高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt,共23页。PPT课件主要包含了情境引入,表示方法,电离平衡常数,强弱电解质的比较,学以致用,随堂巩固等内容,欢迎下载使用。
在实验室中,经常将酸进行稀释,需要知道稀释后酸的浓度和H+浓度。
分别取1 mL 2 ml/L 盐酸和1 mL 2 ml/L 醋酸,均加水稀释到10 mL,请问稀释后的溶液,酸的浓度和氢离子浓度分别为多少?
CH3COOH ⇌ H+ + CH3COO−
HCl完全电离酸的浓度与氢离子浓度相等
CH3COOH部分电离酸的浓度与氢离子浓度不相等
HCl = H+ + Cl−
1、含义:在一定条件下,当弱电解质达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数。这个常数叫做电离平衡常数,简称电离常数,用K表示。
(2)一元弱碱的电离常数 Kb
(1)一元弱酸的电离常数 Ka
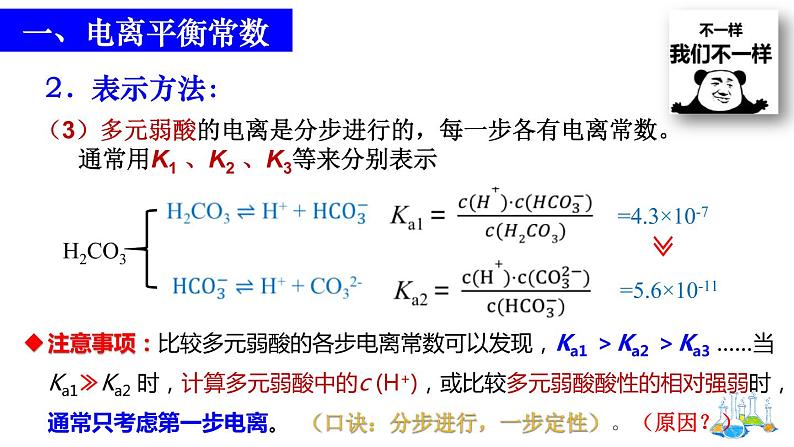
(3)多元弱酸的电离是分步进行的,每一步各有电离常数。 通常用K1 、K2 、K3等来分别表示
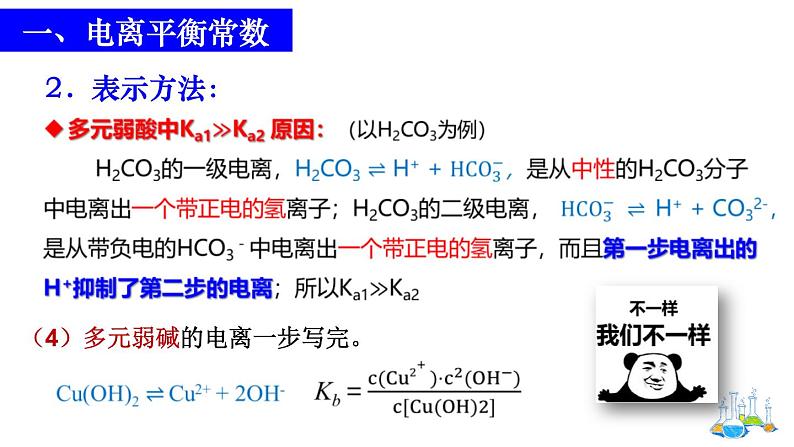
注意事项:比较多元弱酸的各步电离常数可以发现,Ka1 >Ka2 >Ka3 ……当Ka1≫Ka2 时,计算多元弱酸中的c (H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。 (口诀:分步进行,一步定性)。(原因?)
(4)多元弱碱的电离一步写完。
3、电离平衡常数K的计算——(1)K值的求算【例题】在某温度时,溶质的物质的量浓度为 0.2 ml·L−1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10−3 ml·L−1,试计算该温度下NH3·H2O的电离常数Kb。
c(NH3·H2O)=(0.2−1.7×10−3) ml·L−1 ≈ 0.2 ml·L−1
(1)列出“三段式”计算(2)由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a-x) ml·L-1,一般近似为a ml·L-1。(即忽略弱电解质电离的部分)
3、电离平衡常数K的计算——(1)K值的求算
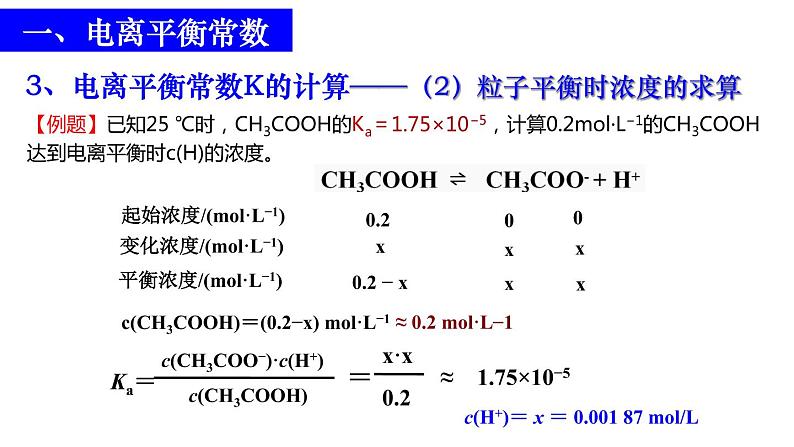
CH3COOH ⇌ CH3COO-+H+起始浓度/(ml·L-1) a 0 0变化浓度/(ml·L-1) x x x平衡浓度/(ml·L-1) a-x x x
c(CH3COOH)=(0.2−x) ml·L−1 ≈ 0.2 ml·L−1
c(H+)= x = 0.001 87 ml/L
【例题】已知25 ℃时,CH3COOH的Ka=1.75×10−5,计算0.2ml·L−1的CH3COOH达到电离平衡时c(H)的浓度。
3、电离平衡常数K的计算——(2)粒子平衡时浓度的求算
【例题】在某温度,溶质的物质的量浓度为 0.2 ml·L−1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10−3 ml·L−1,试计算有多少比例的NH3·H2O发生了电离?
电离度:实际上是一种平衡转化率,表示弱电解质在水中的电离程度。 即:已电离的电解质分子数占原有电解质分子总数的百分率
3、电离平衡常数K的计算——(3)电离度的计算
【思考】对比如下数据,电离平衡常数受哪些因素的影响?
表1:25℃ 几种弱酸的 Ka
表2:不同温度下CH3COOH的 Ka
相同温度下,Ka 越大,弱酸越易电离,酸性越强。
(2)外因:温度;升高温度,平衡正向移动,电离常数 K 增大。
(1)内因:弱酸的自身性质决定。
4、影响电离平衡常数K的因素
K的意义:K表征了弱电解质的电离能力。根据相同温度下,电离常数的大小可以判断弱电解质的相对强弱。1、判断弱电解质的相对强弱弱酸的Ka越大,电离程度越大,越容易电离出H+,酸性越强。弱碱的Kb越大,电离程度越大,越容易电离出OH-,碱性越强。
二、电离平衡常数的应用
反应生成了CO2,化学方程式为:2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑
CH3COOH的酸性比H2CO3的强,Ka(CH3COOH) > Kal(H2CO3)
1、判断弱电解质的相对强弱弱酸的Ka越大,电离程度越大,越容易电离出H+,酸性越强。弱碱的Kb越大,电离程度越大,越容易电离出OH-,碱性越强。P61【实验3-2】
2、强酸制弱酸——弱酸与盐溶液的反应规律利用电离平衡常数,可以判断复分解反应能否发生,以及确定产物。
酸性:HCOOH > HCN
HCOOH+NaCN===HCN+HCOONa
【例题】 已知:Ka(HCOOH)=1.77×10-4 ml·L-1 Ka(HCN)=4.9×10-10 ml·L-1
HCOONa 与 HCN不反应
问下列反应是否能发生,若能发生请写出化学方程式:(1)HCOOH与NaCN溶液:
(2)HCOONa 与 HCN溶液:
3、比较溶液中离子浓度的大小
【例题】已知:磷酸存在的三步电离,这三步的电离常数大小进行比较,第一步 第二步 第三步。H3PO4 ⇌H+ + H2PO4- H2PO4- ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- 在磷酸溶液中粒子大小进行比较:C(H+) c(H2PO4-) c(HPO42-) c(PO43-) c(OH-)
【练习】求H2S溶液的微粒浓度大小关系分别为:
【例题】已知在25℃下,H2CO3和HClO的电离常数如下:H2CO3 的 Ka1=4.5×10-7, Ka2=4.7×10-11,HClO的Ka=3.2×10-8在Na2CO3和NaClO的混合溶液中逐滴加入稀硫酸,发生离子方程式的先后顺序为: 、 、 。 将少量CO2通入NaClO的溶液中的离子方程式: 。
4、比较离子结合质子的能力大小:弱酸的Ka值越小,酸性越弱,酸根阴离子结合H+的能力就越强。
【思考】设计实验证明: 醋酸溶液中存在CH3COOH ⇌ CH3COO-+H+的电离平衡。
①测定0.1ml/L的醋酸溶液的PH:
②在醋酸溶液中滴入石蕊溶液,溶液呈红色,再加热溶液。
加热后红色变深。说明加热能促进醋酸的电离,c(H+)增大,红色加深。即可证明醋酸溶液中存在电离平衡。
③在醋酸溶液中滴入石蕊溶液,溶液呈红色,再加入少量CH3COONH4固体。
④在室温下,将锌粒投入相同浓度的醋酸和盐酸中,比较起始速率大小。
三、弱电解质的证明方法
2=pHHA”“
相关课件
这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件,共17页。
这是一份人教版 (2019)选择性必修1第一节 电离平衡优秀课件ppt,共28页。PPT课件主要包含了情境导入,知识回顾,课前预习,电离平衡常数,知识精讲,思考与讨论,你知道吗,查阅资料,课堂小结,课堂检测等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀ppt课件,共28页。PPT课件主要包含了学习目标,加水稀释促进电离等内容,欢迎下载使用。









