





高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热课文配套ppt课件
展开化学反应一般都有反应热,如何表示一个具体化学反应的反应热呢?
表明反应所放出或吸收的_______的化学方程式
不仅表明了化学反应中的____________,也表明了化学反应中的______________。
H2(g) + Cl2(g) = 2HCl(g) ΔH =﹣184.6 kJ/ml
意义:表示1ml气态H2与1ml气态O2完全反应,生成2ml气态HCl时,放出 184.6kJ的热量。
说出下列热化学方程式的意义:
(1)2H2(g) + O₂(g) 2H₂O(g) ∆H=﹣483.6 kJ/ml
意义:表示2ml气态H2与1ml气态O2完全反应,生成2ml气态H₂O时,放出 483.6kJ的热量。
(2) 2NH3(g) = N2(g)+3H2(g) ΔH = + 92.4kJ/ml
意义:表示2ml气态NH₃完全反应,生成1ml气态H₂和3ml气体H₂时,吸收 92.4kJ的热量。
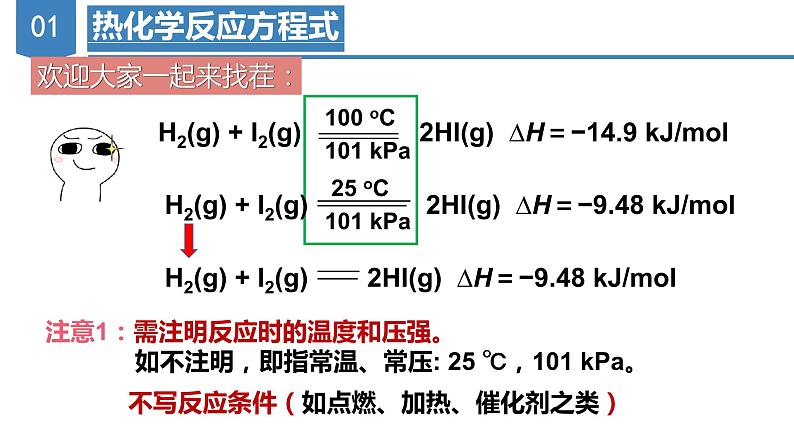
H2(g) + I2(g) 2HI(g) ∆H=−9.48 kJ/ml
H2(g) + I2(g) 2HI(g) ∆H=−14.9 kJ/ml
H2(g) + I2(g) 2HI(g) ∆H=−9.48 kJ/ml
注意1:需注明反应时的温度和压强。 如不注明,即指常温、常压: 25 ℃,101 kPa。
不写反应条件(如点燃、加热、催化剂之类)
固态(____)、液态(____)、气态(____)、水溶液(____)
物质的聚集状态不同时,它们所具有的内能、焓也均不同。
注:不用“↓”和“↑”。
注意2:需注明反应物和生成物的聚集状态。
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/ml
2NH3(g) = N2(g)+3H2(g) ΔH = + 92.4kJ/ml
注意3: ∆H的符号( 吸收 “+” 、释放 “” )
注意4:1、 1. 化学计量数不表示分子数,仅表示物质的量(可以是整数,也可以是分数)
2、对于同一化学反应,如果化学计量数扩大或缩小,那么ΔH的数值也同时___________________
扩大或缩小相同的倍数,化学计量数与△H要一一对应
2H2(g) + O2(g) === 2H2O(g) ∆H2 =−483.6 kJ/ml
注意5:对可逆反应,正逆反应的ΔH数值相等,符号相反。
注意6: 不管反应是可逆反应还是不可逆反应,热化学方程式中的热效应都是指完全反应时的热效应。 计算可逆反应的反应热时,要注意其不能进行到底,实际热量数值小于该数值。
ΔH 的单位中“ml-1”的含义——
指的是“每摩尔反应”,如:
2H2(g) + O2(g) = 2H2O(g) ΔH =﹣483.6 kJ/ml
(2)常温下,1 L 1 ml/L HCl和 1 L 1 ml/L NaOH溶液恰好完全反应放出 57.3 kJ的热量,写出此反应的热化学反应方程式。
(1)当1 ml气态H2与1 ml气态Cl2反应生成2 ml气态HCl,放出184.6 kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g)=2HCl(g) ∆H = −184.6 kJ/ml
HCl(aq) + NaOH(aq) == NaCl(aq) + H2O(l) ∆H=−57.3 kJ/ml
(3)25 ℃ 、1.01×105 Pa下,4 g CO在氧气中燃烧 CO2,放出 9. 6 kJ热量,写出燃烧的热化学反应方程式。
2CO (g) + O2 (g) === 2CO2 (g) ∆H = −134.4 kJ/ml
1、写出下列反应的热化学方程式。
(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ
(4)已知强酸与强碱稀溶液发生中和反应生成1ml H2O放热57.3 kJ,则2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/ml
(1)H2 + Cl2= 2HCl △H = – 183 kJ/ml
3、判断下列热化学方程式正误,指出错误原因。
(3)H2(g) + Cl2(g) = 2HCl(g) △H = 183 kJ/ml
(6)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/ml
“五查”法判断热化学方程式正误
①看方程式是否配平; ②看各物质的聚集状态是否正确; ③看ΔH 变化的“+”、“-”是否正确; ④看反应热的单位是否为 kJ·ml-1; ⑤看反应热的数值与化学计量数是否相对应。
4.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )A.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=+725.8 kJ·ml-1B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·ml-1C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.8 kJ·ml-1D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.52 kJ·ml-1
1、定义: 在101 kPa 时,_______纯物质______燃烧生成__________ 时所放出的热量。
C → ; H → ;S → ;N →_______。
kJ·ml-1,ΔH<0
例如:25℃,101 kPa,1 ml CH4 完全燃烧,放出 890.31 kJ 的热量,这就是 CH4 的燃烧热。用热化学方程式表示如下:
3、燃烧热的意义∶甲烷的燃烧热为ΔH=-890.31 kJ·ml,它表示25 ℃、101 kPa时, 1 mlCH4完全燃烧生成CO2和液态H2O时放出890.31 kJ的热量。4、表示方式:文字叙述燃烧热时用正值,用ΔH表示时,要加“-”。如:CH4的燃烧热为890.3 kJ·ml-1或CH4的燃烧热 ΔH=-890.3 kJ·ml-1
4.表示燃烧热的热化学方程式的书写
注意:以1ml可燃物为配平标准,其余可出现分数。
表示其燃烧热的热化学方程式为:
例如:H2(g)的燃烧热为285.8kJ·ml-1
写出下列物质燃烧热的热化学方程式
1. 下列热化学方程式中△H代表燃烧热的是( )A . CH4(g)+3/2O2 (g)=2H2O(l)+CO(g) △H1B . S(g)+3/2O2(g)=SO3(s) △H2C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3D . 2CO(g)+O2(g)= 2CO2(g) △H4
2、下列热化学方程式中能表示可燃物燃烧热的是( )A.CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·ml-1B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·ml-1C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·ml-1D.2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·ml-1
4. 下列各组物质的燃烧热相等的是:( ) A.炭和一氧化碳 B.1ml炭和2ml炭 C.1ml乙炔和2ml炭 D.淀粉和纤维素
5. 在25 ℃、101 kPa时,H2在1.0 ml O2中完全燃烧生成2.0 ml H2O(l)放出571.6 kJ的热量。该条件下,H2的燃烧热ΔH为________________。
-285.8 kJ·ml-1
含义:既表示物质变化,又表示能量变化
书写:标状态;有正负; 看系数;有温度&压强(常温常压不标)
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件,共27页。PPT课件主要包含了学习目标,课前导入,只表示物质变化,热化学方程式,化学方程式,知识点一,书写步骤,①写方程式,②标状态,③标条件等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热授课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热授课ppt课件,共19页。PPT课件主要包含了思考交流,有什么不足,热化学方程式,每mol反应的焓变,练后反思,三燃烧热,kPa,mol,例题分析,8kJ等内容,欢迎下载使用。
高中化学第一节 反应热精品课件ppt: 这是一份高中化学第一节 反应热精品课件ppt,文件包含112热化学方程式燃烧热练习解析版docx、112热化学方程式燃烧热练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













