






所属成套资源:新人教版化学选择性必修2课件PPT全套
- 1.2 《原子结构与元素周期表 (第一课时)》课件 课件 10 次下载
- 1.2 《元素周期律1》(第二课时) 课件 课件 11 次下载
- 2.1 《共价键的三个参数》(第一课时) 课件 课件 9 次下载
- 2.2 《分子结构测定》(第一课时) 课件 课件 11 次下载
- 2.2 《价层电子对互斥模型 》(第二课时)课件 课件 12 次下载
化学第二节 原子结构与元素的性质优秀课件ppt
展开
这是一份化学第二节 原子结构与元素的性质优秀课件ppt,共26页。PPT课件主要包含了电负性,1化学键,2键合电子,3电负性,④变化规律,4应用,判断化学键的类型,电负性相差很大,离子键,相差17等内容,欢迎下载使用。
元素相互化合,相邻的原子之间产生的强烈的化学作用力,形象地叫做化学键。
原子中用于形成化学键的电子称为键合电子
①定义:用来描述不同元素的原子对键合电子吸引力的大小
②意义:电负性越大的原子,对键合电子的吸引力越大。
③大小的标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性。
电负性是相对值,没单位。
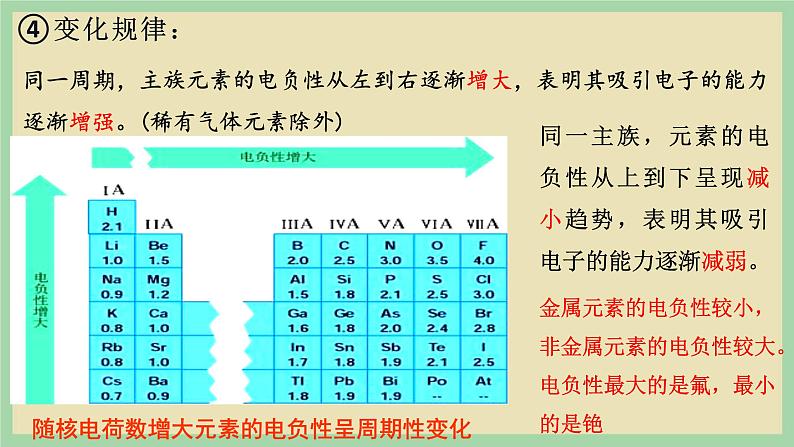
同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强。(稀有气体元素除外)
同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。
随核电荷数增大元素的电负性呈周期性变化
金属元素的电负性较小,非金属元素的电负性较大。电负性最大的是氟,最小的是铯
a、判断元素金属性和非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。①金属元素的电负性一般小于1.8。②非金属元素的电负性一般大于1.8。③位于非金属三角区边界的“类金属”,电负性在1.8左右,既表现金属性,又表现非金属性。
c、判断化合物中各元素化合价的正负
电负性大的显负价,电负性小的显正价。
电负性相差越大的共价键,共用电子对偏向电负性大的原子趋势越大,键的极性越大。
(1)电负性数值小的元素,在化合物中吸引键合电子的能力弱,元素的化合价为正值。(2)电负性数值大的元素,在化合物中吸引键合电子的能力强,元素的化合价为负值。
但也有特例(如NaH)
①概念:在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则。②对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。③相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
体现对角线规则的相关元素
d、利用电负性解释元素的“对角线”规则
“对角线规则”可以通过元素的电负性进行解释:Li、Mg的电负性分别为1.0、1.2;Be、Al的电负性分别为1.5、1.5;B、Si的电负性分别为2.0、1.8。它们的电负性接近,说明它们对键合电子的吸引力相当,它们表现出的性质相似。如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;Be(OH)2、Al(OH)3均属于难溶的两性氢氧化物;B、Si的含氧酸都是弱酸等。
规律总结 电负性是不同元素的原子对键合电子吸引力大小的量度,电负性越大,非金属性越强。电负性的大小能用来判断元素之间的成键类型,也可以用来判断元素化合价的正负。电负性相同或差值小的非金属元素的原子之间形成的化学键主要是共价键,当电负性差值为零时通常形成非极性共价键;差值不为零时,形成极性共价键;而且差值越小,形成的共价键极性越弱。
⑤电负性与第一电离能的关系
电负性用于衡量原子吸引键合电子的能力,电负性大的原子吸引电子的能力强,所以一般来说,电负性大的原子对应元素的第一电离能也大。
(1)同主族元素的电负性有何变化规律?同周期主族元素的电负性与原子半径之间有何关系?提示:同主族元素,核电荷数越大电负性越小。同周期主族元素的电负性随原子半径的减小而增大。
(2)元素周期表中电负性最大的元素是哪种元素?电负性最小的元素是哪种元素(放射性元素除外)?提示:电负性最大的元素为F元素;电负性最小的元素为Cs元素。(3)钙元素的电负性应该在哪两种主族元素之间?提示:根据Ca元素在周期表中的位置,可知电负性:Kr(B)。 ( )2.离子半径:r(Li+)
相关课件
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律优质课课件ppt,共26页。
这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质说课ppt课件,共60页。PPT课件主要包含了第2课时元素周期律,课前·新知导学,微思考,基态原子,基态正离子,半充满,化学作用力,化学键,吸引力,类金属等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质公开课ppt课件,共29页。PPT课件主要包含了元素周期律,原子半径,1影响因素,2递变规律,电离能,1概念,4电离能的意义,6逐级电离能,可以表示为,2变化规律等内容,欢迎下载使用。










