



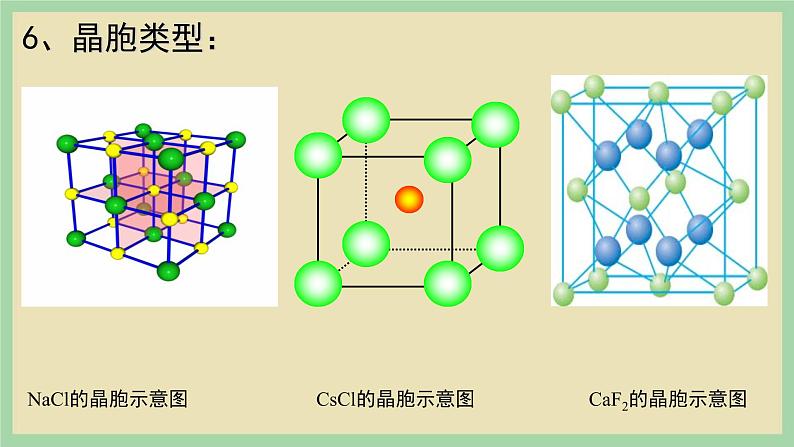

- 3.1 《晶体与非晶体》(第一课时) 课件 课件 11 次下载
- 3.2 《共价晶体》 (第二课时)课件 课件 13 次下载
- 3.2 《分子晶体 》(第一课时)课件 课件 13 次下载
- 3.3 《金属键与金属晶体 》(第一课时)课件 课件 11 次下载
- 3.4 《配合物和超分子》(第一课时) 课件 课件 11 次下载
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体试讲课课件ppt
展开强碱、活泼金属氧化物、大部分的盐类。
由阳离子和阴离子通过离子键结合而成的晶体。
5、离子晶体的物理性质
具有较高的熔、沸点,难挥发:离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔、沸点和难挥发的性质。一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
离子晶体的硬度较大,难于压缩。阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
离子晶体中,离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
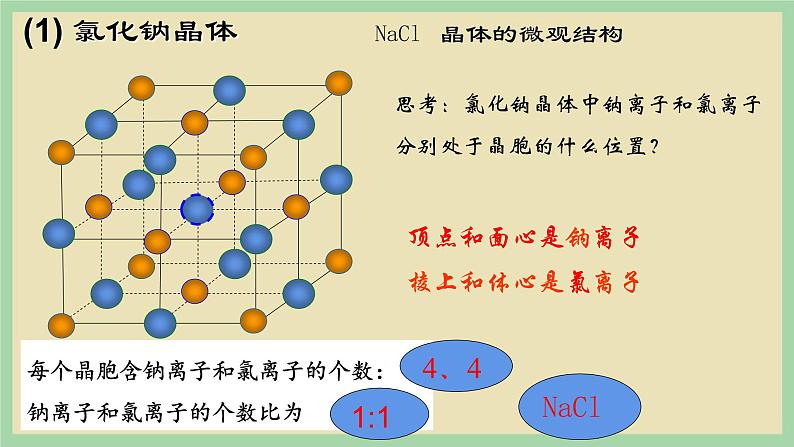
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
每个晶胞含钠离子和氯离子的个数:钠离子和氯离子的个数比为
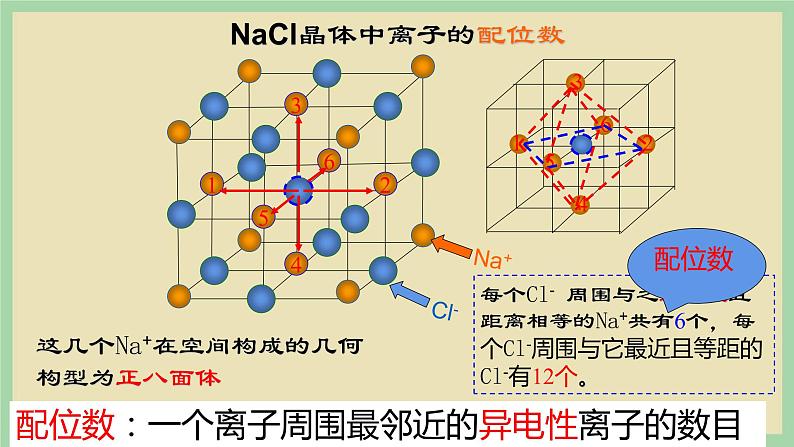
每个Cl- 周围与之最接近且距离相等的Na+共有6个,每个Cl-周围与它最近且等距的Cl-有12个。
这几个Na+在空间构成的几何构型为正八面体
NaCl晶体中离子的配位数
配位数:一个离子周围最邻近的异电性离子的数目
氯化铯晶胞中氯离子和铯离子分别处于晶胞的什么位置?
氯离子位于顶点,铯离子位于体心。
(1)离子晶体中除含有离子键外,是否含有共价键?提示:离子晶体中除含有离子键外,可能含有共价键。如Na2O2、NaOH、Ba(OH)2、NH4Cl、Na2SO4中均含离子键和共价键。(2)离子晶体的熔点一定低于共价晶体吗?提示:不一定。离子晶体的熔点不一定低于共价晶体。如MgO是离子晶体,SiO2是共价晶体,但MgO的熔点高于SiO2的熔点。(3)碳化硅、二氧化碳、碳酸钠均为含碳化合物,分别属于哪类晶体?三者的熔点由低到高的顺序如何?提示:碳化硅是共价晶体,二氧化碳是分子晶体,碳酸钠是离子晶体。熔点由低到高的顺序是二氧化碳<碳酸钠<碳化硅。
三、过渡晶体与混合型晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。如:第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
从表中数据可见,前四种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,而是离子晶体和共价晶体之间的过渡晶体。 通常把偏向离子晶体的过渡晶体当作离子晶体,如Na2O等;偏向共价晶体的过渡晶体当作共价晶体,如Al2O3、SiO2等。
石墨中的碳原子是sp2杂化,形成平面六元并环结构,因此石墨晶体是层状结构。层内的碳原子通过共价键相连,层间靠范德华力维系。有一个未参与杂化的2p电子,所有的p轨道相互平行而且相互重叠,使p轨道的电子可在整个碳原子平面中运动,所以石墨有类似金属晶体的导电性。
既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
(1)石墨属于混合(过渡)晶体,既有共价键、又有金属键,还有范德华力,兼具有原子晶体、分子晶体、金属晶体的特征。(2)石墨分层,层间为范德华力,层内碳原子通过共价键结合。各层之间以范德华力结合,容易滑动,所以石墨质软。 (3)石墨晶体中最小环为六元环(如图所示),键角为120°,在层内,每个碳原子与3个碳原子形成C—C键,构成正六边形,键长相等,键角相等(均为120°);在晶体中,每个碳原子参与3个C—C键的形成,而每个碳原子对每个共价键的贡献只有一半,故每个正六边形平均占有的碳原子数为 碳原子个数与C—C键数之比为
四、物质熔点、沸点高低的比较
晶体的熔、沸点受组成晶体的粒子之间的作用力类型和强弱的影响。分子晶体中存在的是分子间作用力,比化学键弱得多,因此其熔、沸点比较低,原子晶体中原子之间以共价键结合,金属晶体中是金属阳离子和自由电子之间形成的金属键,离子晶体中是离子键,这些作用都是化学键,比分子间作用力强得多,因此它们的熔、沸点一般比分子晶体要高。但是由于各类化学键又存在强弱的差异,所以又有不同。另外,即使是同一类型的化学键,由于成键主体不同,也会存在差异。具体如下:
1.不同类型的晶体一般来说,晶体的熔、沸点是:原子晶体>离子晶体>分子晶体。2.同类晶体(1)原子晶体:熔、沸点取决于共价键的键能和键长,键能越大、键长越短,熔、沸点越高。如熔、沸点:晶体硅<金刚砂(SiC)<金刚石。(2)离子晶体:熔、沸点取决于离子键的强弱。一般来说,离子半径越小,离子电荷数越多,离子键越强,熔、沸点越高。如KF>KCl>KI,NaCl>MgO。
(3)分子晶体:熔、沸点的高低,可通过比较分子间作用力的大小和有无氢键的存在来判断。①分子间作用力:组成和结构相似的物质,随相对分子质量的增大,分子间作用力增大,其熔、沸点升高。如F2
1.判断正误(正确的打“√”,错误的打“×”)
2.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,进行下列实验。其中合理、可靠的是( )A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物D.测定SbCl3、SbCl5、SnCl4水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
解析:离子晶体中含有离子键,离子键是阴、阳离子之间强烈的相互作用,故离子晶体往往有较高的熔点,A项错而B项正确;滴入HNO3酸化的AgNO3溶液,产生白色沉淀,只能说明这些物质溶于水时产生了Cl-,有的共价化合物溶于水时也能产生Cl-(如HCl),C错;有些共价化合物的水溶液也能导电,如HCl,D错。
3.下列说法错误的是( )A.离子晶体在熔化状态下能导电B.在晶体中只要有阴离子就一定有阳离子C.共价晶体中一定有非极性共价键D.分子晶体中不一定含有共价键解析:SiO2晶体中只有极性键;稀有气体形成的分子晶体中没有化学键。
4.下列关于晶体的说法一定正确的是( )A.分子晶体中都存在共价键B.CaTiO3晶体(如图所示)中每个Ti4+和12个O2-相紧邻C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金属晶体的熔点都比分子晶体的熔点高
CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
解析:稀有气体都是单原子分子,它们的晶体中不存在共价键,A项不正确;在题目所给晶体结构模型中,每个Ti4+周围有3个O2-与之相邻,晶体中每 Ti4+周围共有3×8× =12个O2-,B项正确;在SiO2的晶体中Si、O以单键相结合,故每个硅原子与4个氧原子相结合,C项不正确;金属汞的熔点比I2、蔗糖等分子晶体的熔点低,D项不正确。
人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教案配套ppt课件: 这是一份人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教案配套ppt课件,共39页。PPT课件主要包含了离子晶体,共价晶体,分子晶体,O2或O3,共价键,①②③④,HF分子间形成氢键,NOC,三角锥形,sp2等内容,欢迎下载使用。
人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体多媒体教学课件ppt: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体多媒体教学课件ppt,共51页。PPT课件主要包含了问题探讨等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体说课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体说课ppt课件,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。













