









初中化学人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱多媒体教学课件ppt
展开知识与技能:了解酸的通性及原理,能书写有关的化学方程式,知道物质的性质和用途之间的联系。
过程与方法:通过对酸和碱知识的梳理,学习归纳方法,感悟对比、推理及理论联系实际的方法。
情感态度与价值观:体会化学与人类有密切关系,增强学习化学的信心,同时提高实验过程中的“规则意识”。
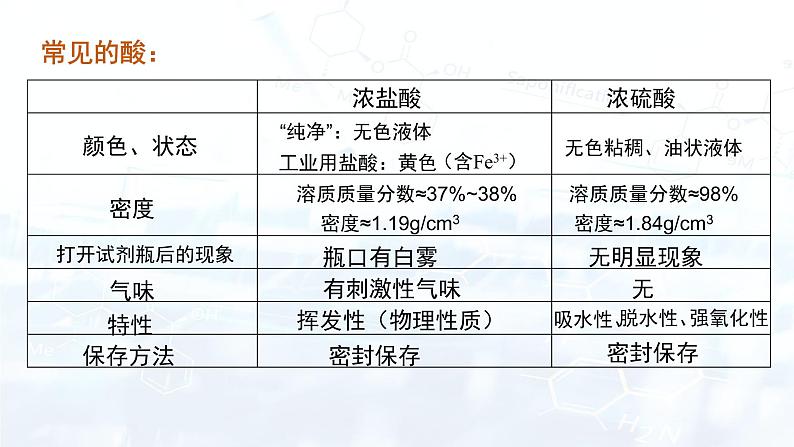
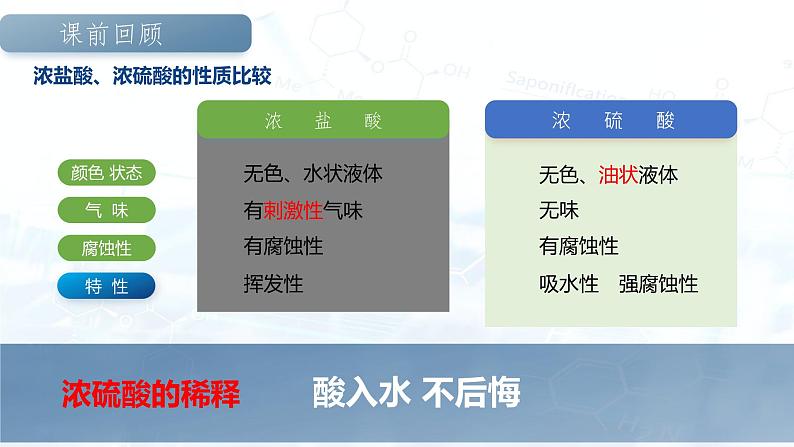
浓盐酸、浓硫酸的性质比较
在不借用试剂的前提下,你可以使紫色的石蕊变成红色吗?
上节课我们学过盐酸和硫酸可以使紫色石蕊试液变红,其他酸可以吗
紫色石蕊试液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊试液变红吗?
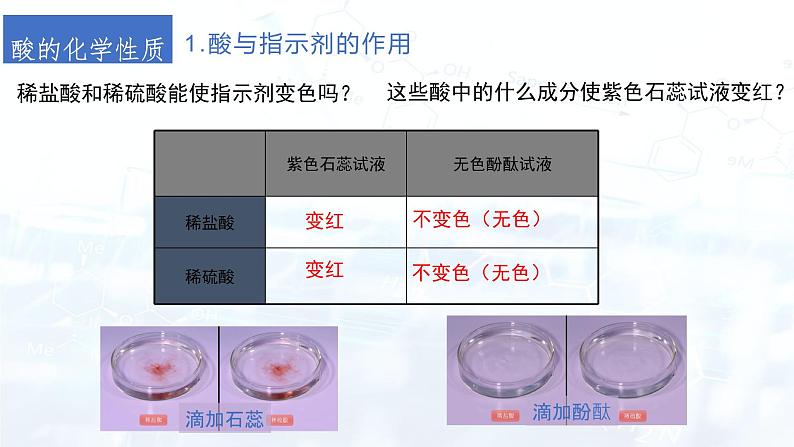
稀盐酸和稀硫酸能使指示剂变色吗?
这些酸中的什么成分使紫色石蕊试液变红?
优点:操作简单、节约药品、便于对照、效果较好。
上述实验也可以在点滴板上进行,想一想用点滴板进行实验有什么优点?
2、酸与活泼金属的反应
Mg + 2HCl = MgCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
酸 + 活泼金属 → 盐 + 氢气
生成物的共同点:都有氢气生成
注:含有Fe2+的溶液显浅绿色
因为食醋中含有醋酸,能与铁、铝发生化学反应,长时间烹饪会导致铁锅或铝制品腐蚀
为什么不可将醋放在铁锅中长时间烹调,不可用铝制品调拌要放醋的凉菜?
活泼金属是指活动性排在氢前的金属这里的酸不包括浓硫酸和硝酸。
3、酸与金属氧化物的反应
在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出铁钉,用水洗净,铁钉表面和溶液颜色有什么变化?
铁钉表面的铁锈被除去,溶液变为黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
酸+金属氧化物→盐+水
注:含有Fe3+的溶液显黄色
1.这两个反应的生成物之一都是水,另一生成物是由金属离子和酸根离子构成的化合物。2.利用酸可以清除铁制品表面的锈,但不能将铁制品长时间浸在足量的酸中,因为酸会继续与铁反应,造成铁制品的腐蚀。
酸的化学性质--酸与金属氧化物反应
在两支装有黑色氧化铜粉末的试管里分别倒入适量的稀硫酸和稀盐酸,观察试管中的现象。
黑色粉末逐渐溶解,溶液由无色变为蓝色
CuO+H2SO4 =CuSO4 +H2O
CuO+2HCl = CuCl2 +H2O
盐酸和硫酸为什么有这些相似的化学性质?
HCl和H2SO4在水中解离出离子
HCl = H+ + Cl-
H2SO4=2H+ + SO42-
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
石蕊溶液遇酸变红色酚酞溶液遇酸不变色
生成由金属离子和酸根离子构成的化合物和水
2.下列关于酸的说法正确的是( )A.都含有氧元素B.能与碱反应生成盐和水的物质都是酸C.都能与金属反应生成氢气D.都能解离出H+
1. 日常生活中下列物质能使紫色石蕊溶液变红的是( )A. 蒸馏水 B. 食醋 C. 食盐水 D. 石灰水
3、试管壁上附着的下列物质,不能用稀盐酸浸泡除去的是: A. 盛石灰水后留下的白色物质 B. 做一氧化碳还原氧化铁实验后留下的黑色物质 C. 做铁钉生锈实验后留下的红棕色物质 D. 做氢气还原氧化铜实验后留下的红色物质
4、下列物质中,能直接用金属与盐酸反应制得的是: A.FeCl3 B. ZnCl2 C.AgCl D. CuCl2
5、如图是稀硫酸与不同物质之间发生化学反应的颜色变化
(1)①处所使用的指示剂是 ;
(2)请你在编号②③处各填入一种物质。②是 ;③是 ;
(3)反应②涉及的基本反应类型是 ;
(4)如果想要得到黄色溶液,那么有稀硫酸参与反应的方程式 ;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
初中化学课题1 常见的酸和碱课文配套ppt课件: 这是一份初中化学课题1 常见的酸和碱课文配套ppt课件,文件包含课题1常见的酸和碱pptx、第10单元课题1第1课时DOC、第10单元课题1第2课时DOC、第10单元课题1第3课时DOC、浓硫酸的脱水性视频asf、稀释浓硫酸视频asf等6份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2021学年课题1 常见的酸和碱课堂教学ppt课件: 这是一份2021学年课题1 常见的酸和碱课堂教学ppt课件
人教版九年级下册课题1 常见的酸和碱示范课ppt课件: 这是一份人教版九年级下册课题1 常见的酸和碱示范课ppt课件,共60页。PPT课件主要包含了酸的化学性质,小结酸的化学性质,碱的化学性质,想一想,反馈练习等内容,欢迎下载使用。













