






- 《乙烯与有机高分子材料》第一课时课件PPT+教学设计 课件 68 次下载
- 《乙烯与有机高分子材料》第二课时课件PPT+教学设计 课件 67 次下载
- 《乙醇与乙酸》第二课时课件PPT+教学设计 课件 73 次下载
- 《基本营养物质》课件PPT+教学设计 课件 66 次下载
- 《自然资源的开发利用》第一课时课件PPT+教学设计 课件 61 次下载
高中化学第三节 乙醇与乙酸教学课件ppt
展开人教版高中化学必修二
《乙醇与乙酸》第一课时 教学设计
课题名 | 《乙醇与乙酸》第一课时 |
教学目标 | 1.掌握乙醇的分子结构和性质。 2.从微观角度理解乙醇发生化学反应的断键方式。 3.了解乙醇在生活中的作用。 |
教学重点 | 乙醇的分子结构和性质。 |
教学难点 | 乙醇的分子结构和化学性质,从微观角度理解乙醇发生化学反应的断键方式。 |
教学准备 | 教师准备:PPT,实验 学生准备:预习课本 |
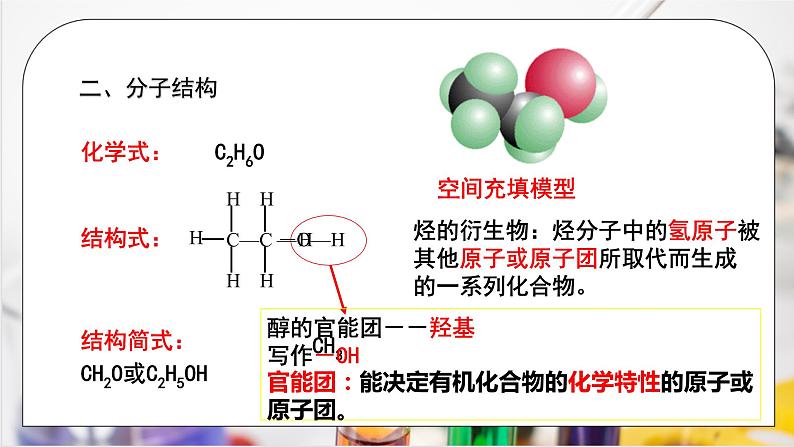
教学过程 | 新课导入 发酵法制酒:将含淀粉的农产品加压蒸煮,加入酵母发酵制得乙醇。 新课讲授 一、物理性质 乙醇俗称酒精 颜色 :无色透明 气味 :特殊香味 状态:液体 密度 :比水小,200C时的密度是0.7893g/cm3 溶解性:跟水以任意比互溶 重要的有机溶剂,能够溶解多种无机物和有机物 挥发性:易挥发 思考:如何分离水和酒精? 由于水和酒精是互溶的,所以通常用蒸馏的方法分离水和酒精。 工业上如何制取无水的乙醇? 先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。 二、分子结构 化学式:C2H6O 结构式:
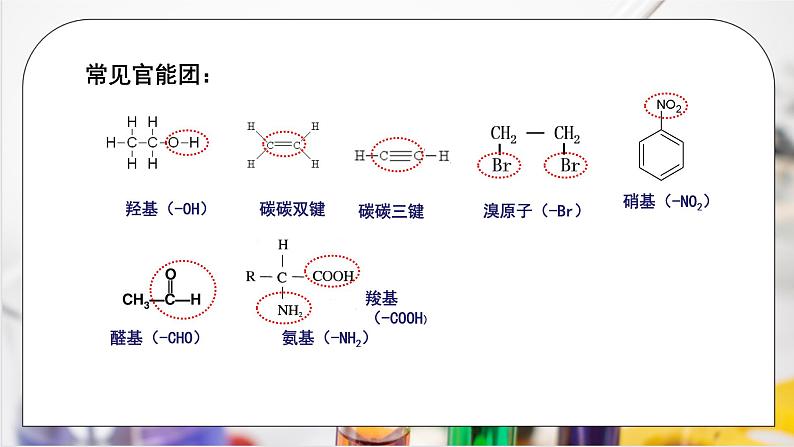
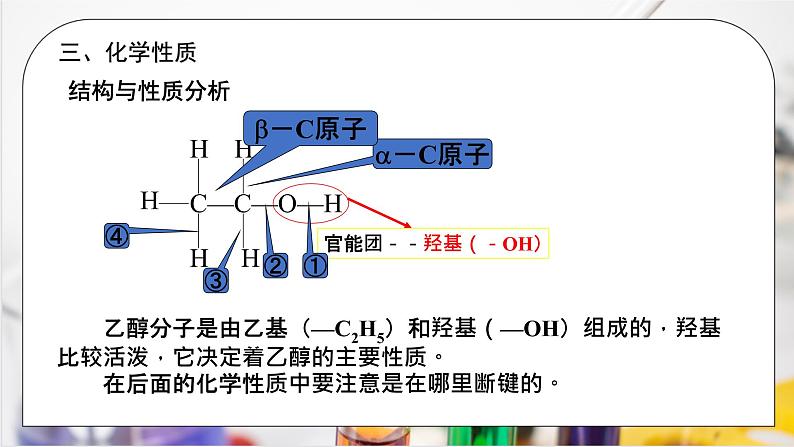
结构简式:CH3CH2O或C2H5OH 醇的官能团--羟基,写作-OH 官能团:能决定有机化合物的化学特性的原子或 原子团。 烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成 的一系列化合物。 常见官能团: 三、化学性质 结构与性质分析 乙醇分子是由乙基(—C2H5)和羟基(—OH)组成的,羟基比较活泼,它决定着乙醇的主要性质。在后面的化学性质中要注意是在哪里断键的。 1、与活泼金属(如Na)反应 2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑ 该反应属于置换反应。 注意:乙醇跟金属钠反应,生成乙醇钠,并放出氢气,H2中的H来自于羟基上的H。 其它活泼金属如钾、镁、铝等也能够把乙醇的羟基里的氢取代出来。思考:乙醇分子中等效氢有几种? 类比: 2Na+2H-O-H=2NaOH+H2↑ 思考:为什么乙醇与钠反应不如钠与水反应剧烈? 乙醇分子羟基中的氢原子不如水分子中的氢原子活泼。 钠与水、乙醇反应的比较 结论:钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基中的H原子的活泼性:乙醇<水 思考:多少mol乙醇与Na反应才能产生1molH2? 2 mol乙醇与足量的Na反应得到1mol H2 说明:1mol-OH~1molNa~0.5molH2 思考:能否通过此反应测定有机物的羟基数目? 练习 2、氧化反应: ① 乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。 C2H5OH + 3O2 2CO2 +3H2O 因此: 乙醇可用作内燃机的燃料,实验室里也常用它作为燃料。 资料:在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。 得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应。 思考:乙醇与氧气的反应,如果改变条件会发生怎样的变化? ②乙醇的催化氧化 现象:光亮的铜丝加热到变黑,将灼热的铜丝迅速插入在乙醇中,铜丝由黑变红,同时产生刺激性气味。 分析: 乙醇在加热和有催化剂(Cu或Ag)存在的条件下,能够被空气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。 2CH3CH2OH + O2 2CH3CHO + 2H2O 思考:当--C上没有氢或只有一个氢的情况又如何氧化呢? 本质:断羟基氢和羟基碳上的氢,与-OH相连的碳原子必须有H才能被氧化。 规律:a、在ɑ--C碳上有2个H时生成醛 b、在ɑ--C碳上只有1个H时生成酮 c、在ɑ--C碳上无H时:不能催化氧化 练习:判断以下醇分子能不能被催化氧化 ③被强氧化剂氧化: 被酸性KMnO4 、酸性K2Cr2O7 溶液氧化为乙酸。 CH3CH2OH CH3COOH 条件控制在有机反应中的作用 四、用途 1、作内燃机的燃料,实验室里也常用它作为燃料 2、重要的有机化工原料和溶剂 3、医疗上常用75%(体积分数)的乙醇溶液作消毒剂 课堂小结
|
布置作业 |
练习册上相应习题 |
板书设计 | 乙醇 一、物理性质 二、分子结构 三、化学性质 1、置换反应:与活泼金属(如Na)反应 2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑ 2、氧化反应: ① 乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。 C2H5OH + 3O2 2CO2 +3H2O ②乙醇的催化氧化 2CH3CH2OH + O2 2CH3CHO + 2H2O ③被强氧化剂氧化: 被酸性KMnO4 、酸性K2Cr2O7 溶液氧化为乙酸。 四、用途 |
教学反思 | 本节课要求学生掌握乙醇的分子结构和性质,从微观角度理解乙醇发生化学反应的断键方式,了解乙醇在生活中的作用。课程本身难度不大,教师应通过实验引导学生搞清楚乙醇发生化学反应的断键方式,掌握乙醇反应的本质。 |
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸集体备课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸集体备课ppt课件,共24页。PPT课件主要包含了擦拭涂改液,消毒水和消毒片,身边的乙醇,视野拓展,你知道吗等内容,欢迎下载使用。
人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸精品课件ppt: 这是一份人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸精品课件ppt,共29页。PPT课件主要包含了密度比水小,易挥发,乙醇的结构,烃的衍生物,官能团,与金属Na反应,钠与水的反应,钠与乙醇的反应,1燃烧,2催化氧化等内容,欢迎下载使用。
人教版 (2019)必修 第二册第三节 乙醇与乙酸优秀课件ppt: 这是一份人教版 (2019)必修 第二册第三节 乙醇与乙酸优秀课件ppt,共28页。














