






所属成套资源:(新高考)高考化学大一轮复习课件 (含解析)
(新高考)高考化学大一轮复习课件第4章第19讲卤素的性质及提取(含解析)
展开
这是一份(新高考)高考化学大一轮复习课件第4章第19讲卤素的性质及提取(含解析),共60页。PPT课件主要包含了复习目标,深红棕,HX+HXO,未知液,2置换萃取法,有机层呈,Br-,卤素离子的检验,NaCNO+H2O,I-+Cl2等内容,欢迎下载使用。
1.掌握卤素的性质及X-的检验。2.掌握溴、碘单质的提取。
卤素的性质及X-的检验
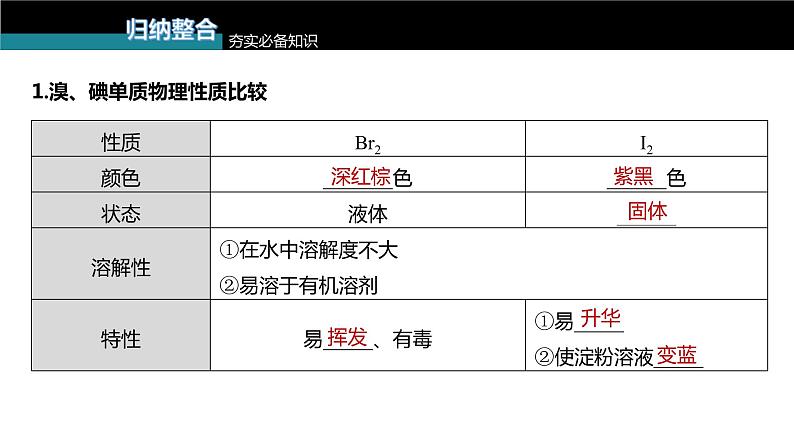
1.溴、碘单质物理性质比较
2.氯、溴、碘单质化学性质比较
NaX+NaXO+H2O
3.氟的特殊性(1)氟无正化合价。(2)F2能与水反应放出O2,故F2不能从其他卤化物的水溶液中将卤素单质置换出来。(3)在HX中,HF的熔、沸点最高,氢氟酸是弱酸,能腐蚀玻璃。4.卤素离子的检验方法(1)AgNO3溶液——沉淀法
____色沉淀,则有Cl-_______色沉淀,则有Br-____色沉淀,则有I-
红棕色或橙红色,表明有_______紫色、浅紫色或紫红色,表明有____
(3)氧化——淀粉法检验I-
1.卤素气态氢化物的水溶液都是强酸溶液( )2.类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3( )3.浓H2SO4能干燥HCl,所以浓硫酸也能干燥HBr( )4.加碘盐能使淀粉变蓝( )5.清洗碘升华实验所用试管的操作是先用酒精清洗,再用水清洗( )6.液溴易挥发,在存放液溴的试剂瓶中应加水封( )7.碘易溶于酒精,所以可用酒精将碘萃取出来( )8.用加热的方法可将NaHCO3中混有的少量碘除去( )9.氟气跟氯化钠溶液反应,一定有氟化氢和氧气生成( )
1.下列叙述正确的是A.氯水久置过程中,氯水的氧化性增强,酸性减弱B.用硝酸酸化的AgNO3溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.向某溶液中加入CCl4,振荡、静置后,CCl4层显紫红色,证明原溶液中存在I-D.某浅黄色的溴水,加CCl4振荡、静置后,上层显橙红色
2.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥CCl4、淀粉溶液A.①②④ B.②③⑥ C.②④⑤ D.④⑤⑥
3.氰[(CN)2]的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。(1)写出(CN)2的电子式:_____________________。(2)写出(CN)2在常温下与烧碱溶液反应的化学方程式:__________________________________________。(3)在KBr、KI、KCN的混合溶液中通入少量氯气,发生反应的离子方程式为______________________。
二、拟卤素和卤素互化物
(CN)2+2NaOH===NaCN+
4.一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似。(1)ICl3与水反应的产物可能为______________(填化学式)。(2)ICl在常温下与烧碱溶液反应的离子方程式为______________________________,该反应是否是氧化还原反应?______(填“是”或“否”)。
ICl+2OH-===Cl-+IO-+H2O
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……(1)A中产生黄绿色气体,其电子式是__________。(2)验证氯气的氧化性强于碘的实验现象是__________________________。
5.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
三、卤素单质氧化性的实验探究
湿润的淀粉-KI试纸变蓝
(3)B中溶液发生反应的离子方程式是__________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________________________________________________________。(5)过程Ⅲ实验的目的是____________________________________________________。(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,__________________,得电子能力逐渐减弱。
Cl2+2Br-===Br2+2Cl-
打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色
确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
1.氯的提取——氯碱工业
电解饱和食盐水的化学方程式为_______________________________________。
2.海水提取溴(1)工艺流程
(2)发生反应的化学方程式①__________________________;②________________________________;③_________________________。
2NaBr+Cl2===Br2+2NaCl
Br2+SO2+2H2O===2HBr+H2SO4
2HBr+Cl2===2HCl+Br2
3.海带中提取碘(1)工艺流程
(2)发生反应的离子方程式:_____________________。
Cl2+2I-===I2+2Cl-
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出C.③中得到的上层溶液中含有I-D.操作Z的名称是加热
1.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是
下列有关说法不正确的是A.X试剂可用Na2SO3饱和溶液B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2C.工业上每获得1 ml Br2,需要消耗Cl2 44.8 LD.步骤Ⅳ包含萃取、分液和蒸馏
2.从淡化海水中提取溴的流程如下:
请你参与分析讨论:(1)图中仪器B的名称是______________。(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_______________。
3.某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
(3)实验装置气密性良好,要达到提纯溴的目的,操作中控制温度计b为________℃。(4)C中溶液颜色为 __________,为除去该产物中残留的Cl2,可向其中加入NaBr溶液,反应的离子方程式为___________________________。
2Br-+ Cl2=== Br2+2Cl-
4.用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
(1)操作Ⅰ的正确图示为______(填字母)。
(2)在清液中加入H2SO4和NaClO溶液后,溶液最终变为棕红色,该步骤中NaClO的量要适中,请说明原因:____________________________________________________________________________________________________________________________________________________________________________________。
第一步:取40 mL 8%~10%的NaOH溶液注入交换柱中。碱性洗脱原理为3R—I3+6OH-===3R—I+5I-+ +3H2O。往碱性洗脱液中滴加H2SO4溶液,烧杯底部析出一层泥状粗碘。
(3)其中交换吸附装置如下图所示,交换柱内装有氯型阴离子交换树脂(用R—Cl表示),溶液转化原理为:R—Cl+ R—I3+Cl-,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行:
第二步:取40 mL 10%的NaCl溶液注入上述交换柱中。氯化钠洗脱原理为R—I+Cl-===R—Cl+I-。再往氯化钠洗脱液中滴加H2SO4溶液使之酸化,再滴加NaNO2溶液,溶液由无色转变棕黑色浑浊。①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对I-进行交换吸附,那实验中将I-转化成 的原因可能是____________________________________________________。
②往氯化钠洗脱液中滴加H2SO4溶液使之酸化,再滴加NaNO2溶液反应的离子方程式:________________________________________。
2NO↑+I2+2H2O
A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I-的Cl2D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
1.(2018·江苏,5)下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单 质溴,再用SO2将其还原吸收
2.(2015·全国卷Ⅱ,12)海水开发利用的部分过程如下图所示。下列说法错误的是
3.[2021·全国甲卷,26(1)(2)]碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:(1)I2的一种制备方法如图所示:
①加入Fe粉进行转化反应的离子方程式为______________________________,生成的沉淀与硝酸反应,生成____________后可循环使用。
2AgI+Fe===2Ag+Fe2++2I-
由流程图可知悬浊液中含AgI,AgI可与Fe反应生成FeI2和Ag,FeI2易溶于水,在离子方程式中能拆,故加入Fe粉进行转化反应的离子方程式为2AgI+Fe===2Ag+Fe2++2I-,生成的银能与硝酸反应生成硝酸银参与循环中。
FeI2+Cl2===I2+
I2被过量的Cl2进一步氧化
通入Cl2的过程中,因I-还原性强于Fe2+,Cl2先氧化还原性强的I-,若氧化产物只有一种,则该氧化产物只能是I2,故反应的化学方程式为FeI2+Cl2===I2+FeCl2;
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为_______________________________________。
1.下列有关卤素的说法错误的是A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
2.下列能够检验出KI中是否含有Br-的实验是A.加入足量的新制氯水,溶液变色则有Br-B.加入酸性KMnO4溶液,观察溶液颜色是否褪去C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-D.加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色 沉淀生成,则含有Br-
3.某小组比较Cl-、Br-、I- 的还原性,实验如下:
下列对实验的分析不合理的是A.实验1中,白烟是NH4ClB.根据实验1和实验2判断还原性:Br->Cl-C.根据实验3判断还原性:I->Br-D.上述实验利用了浓H2SO4的氧化性、难挥发性等性质
B.用淀粉碘化钾试纸和白醋可检验食盐中是否加碘C.生产等量的碘,反应①和反应②转移电子数目之比为2∶5
下列有关说法不正确的是A.氧化1所用的氯气可通过电解饱和NaCl溶液制得B.吹出后剩余溶液中可能大量存在的离子有Na+、Mg2+、Cl-、Br-C.吸收过程发生反应的离子方程式为SO2+Br2+2H2O===4H++2Br-+D.氧化2所得溶液可通过萃取分离出溴
5.“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
由题给流程可知,足量氯气与海水中的溴离子发生置换反应生成溴,用热空气将生成的溴吹出,用二氧化硫的水溶液吸收吹出的溴,溴与二氧化硫水溶液反应生成硫酸和氢溴酸,向硫酸和氢溴酸中通入氯气,氯气与溶液中的氢溴酸发生置换反应生成溴,用合适的有机溶剂萃取溴水中的溴,分液得到溴的有机溶液,蒸馏有机溶液得到液溴。
下列说法错误的是A.NaNO2氧化I-时使溶液pH变大B.活性炭吸附是为了净化水溶液C.I2与NaOH(浓、热)反应的化学方程式:3I2 +6NaOH(浓、热)===5NaI+NaIO3+3H2OD.热空气能吹出I2,是因为I2在水中溶解度小、易升华
6.工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如图:
7.(2022·上海高三模拟)BrCl是一种卤素互化物,与Cl2性质相似,也能与水或碱溶液反应。下列说法正确的是A.BrCl与水反应生成HBrO和HCl,该反应属于氧化还原反应B.1 ml BrCl与KBr溶液完全反应时转移的电子为1 mlC.BrCl可与Cl2反应得到Br2D.BrCl与稀氢氧化钠溶液反应可生成NaBr和NaClO
8.溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为IBr+H2O===HBr+HIO。下列有关IBr的叙述不正确的是A.在与水的反应中,IBr既不是氧化剂又不是还原剂B.在与水的反应中,IBr既是氧化剂又是还原剂C.在很多反应中,IBr是强氧化剂D.IBr跟NaOH稀溶液反应生成NaBr、NaIO和H2O
C.BrCl与Zn反应生成ZnCl2和ZnBr2D.XYn与卤素单质一样都是非极性分子
9.“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物(非金属性:X
相关课件
这是一份新高考化学一轮复习课件 第4章 第19讲 卤素的性质及提取,共60页。PPT课件主要包含了高考化学一轮复习策略,卤素的性质及提取,归纳整合,专项突破,卤素的提取,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份(新高考)高考化学大一轮复习课件第5章第32讲物质结构与性质综合题研究(含解析),共60页。PPT课件主要包含了复习目标,2模板构建,答题模板,P>S,sp3和sp2,三角锥形,H2O,Fe<Cu<S,sp3,真题演练明确考向等内容,欢迎下载使用。
这是一份(新高考)高考化学大一轮复习课件第5章第31讲晶体结构与性质(含解析),共60页。PPT课件主要包含了复习目标,晶体与晶胞,周期性有序,相对无序,不固定,各向异性,各向同性,X射线衍射,熔融态,任何间隙等内容,欢迎下载使用。










