




所属成套资源:(新高考)高考化学大一轮复习课件 (含解析)
(新高考)高考化学大一轮复习课件第7章第43讲化学平衡移动原理及应用(含解析)
展开
这是一份(新高考)高考化学大一轮复习课件第7章第43讲化学平衡移动原理及应用(含解析),共60页。PPT课件主要包含了复习目标,化学平衡的移动,正反应方向,不发生,逆反应方向,正反应,逆反应,减弱这种改变,减小不变,不移动等内容,欢迎下载使用。
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关 理论解释其一般规律。2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
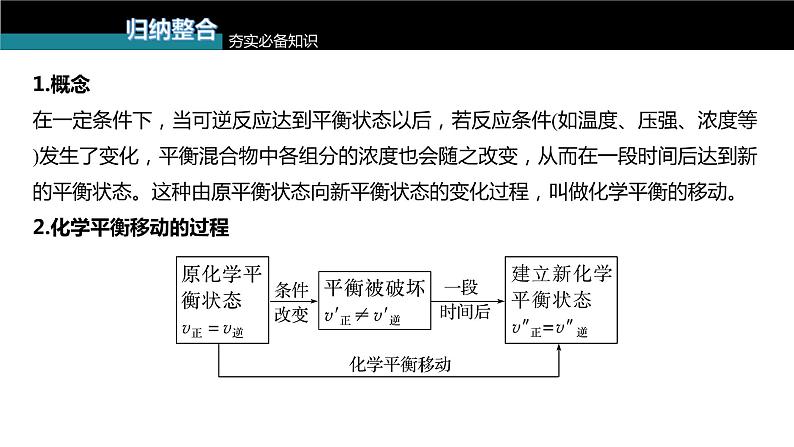
1.概念在一定条件下,当可逆反应达到平衡状态以后,若反应条件(如温度、压强、浓度等)发生了变化,平衡混合物中各组分的浓度也会随之改变,从而在一段时间后达到新的平衡状态。这种由原平衡状态向新平衡状态的变化过程,叫做化学平衡的移动。2.化学平衡移动的过程
3.化学平衡移动与化学反应速率的关系(1)v正>v逆:平衡向 移动。(2)v正=v逆:反应达到平衡状态,平衡 移动。(3)v正<v逆:平衡向 移动。
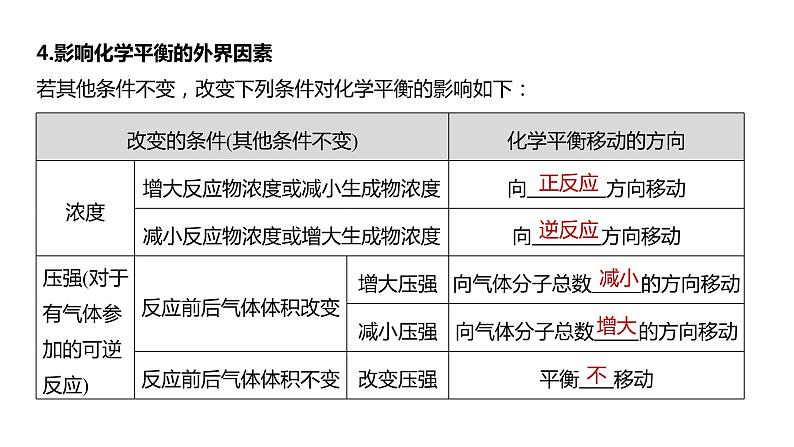
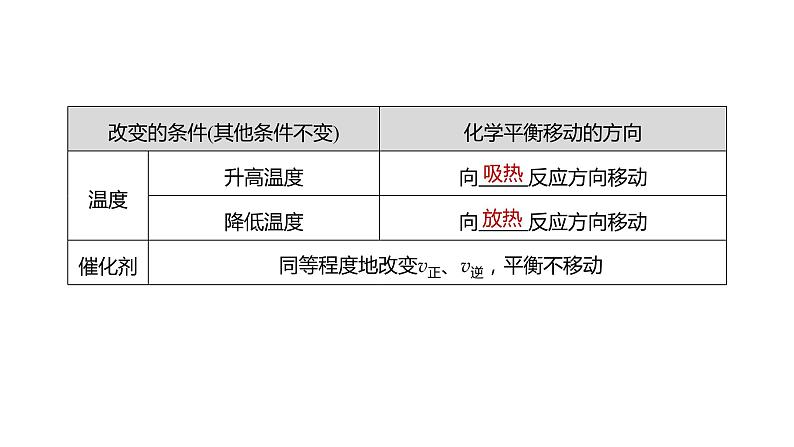
4.影响化学平衡的外界因素若其他条件不变,改变下列条件对化学平衡的影响如下:
5.化学平衡中的特殊情况(1)当反应混合物中存在与其他物质不相混溶的固体或液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或液体的量,对化学平衡没影响。(2)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。(3)充入惰性气体与平衡移动的关系①恒温、恒容条件
6.勒夏特列原理及应用
一、温度、压强对化学平衡移动的影响1.对于一定条件下的可逆反应甲:A(g)+B(g) C(g) ΔH<0乙:A(s)+B(g) C(g) ΔH<0丙:A(g)+B(g) 2C(g) ΔH>0达到化学平衡后,只改变一种条件,按要求回答下列问题:(1)升温,平衡移动的方向分别为甲______(填“向左”“向右”或“不移动”,下同);乙_____;丙_____。此时反应体系的温度均比原来____(填“高”或“低”)。混合气体的平均相对分子质量变化分别为甲_____(填“增大”“减小”或“不变”,下同);乙_____;丙______。
(2)加压,使体系体积缩小为原来的①平衡移动的方向分别为甲______(填“向左”“向右”或“不移动”,下同);乙________;丙_______。②设压缩之前压强分别为p甲、p乙、p丙,压缩后压强分别为p′甲、p′乙、p′丙,则p甲与p′甲,p乙与p′乙,p丙与p′丙的关系分别为甲_______________;乙___________;丙___________。③混合气体的平均相对分子质量变化分别为甲_____(填“增大”“减小”或“不变”,下同);乙_____;丙_____。
p甲<p甲′<2p甲 p乙′=2p乙
二、惰性“气体”对化学平衡移动的影响2.在密闭容器中,反应:xA(g)+yB(g) zC(g),在一定条件下达到平衡状态,试回答下列问题:(1)若保持体积不变,通入氦气,则平衡____移动。(2)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为________。
三、虚拟“中间态”法判断平衡移动的结果3.对于以下三个反应,从反应开始进行到达到平衡后,保持温度、体积不变,按要求回答下列问题。(1)PCl5(g) PCl3(g)+Cl2(g)再充入PCl5(g),平衡向________方向移动,达到平衡后,PCl5(g)的转化率_____,PCl5(g)的百分含量______。(2)2HI(g) I2(g)+H2(g)再充入HI(g),平衡向_______方向移动,达到平衡后,HI的分解率______,HI的百分含量_____。
(3)2NO2(g) N2O4(g)再充入NO2(g),平衡向________方向移动,达到平衡后,NO2(g)的转化率______,NO2(g)的百分含量_____。(4)mA(g)+nB(g) pC(g)同等倍数的加入A(g)和B(g),平衡______移动,达到平衡后,①m+n>p,A、B的转化率都_____,体积分数都_____;②m+n=p,A、B的转化率、体积分数都_____;③m+n
相关课件
这是一份课件:2024届高考化学一轮复习:《第23讲化学平衡状态的建立与移动》,共1页。
这是一份新高考化学一轮复习课件 第7章 第43讲 化学平衡移动原理及应用,共60页。PPT课件主要包含了高考化学一轮复习策略,化学平衡的移动,归纳整合,专项突破,工业合成氨,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份2022年高考化学一轮复习课件 第7章 第34讲 化学平衡状态 化学平衡的移动 (含解析),共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,同一条件,质量或浓度,2建立,3平衡特点,错误的写明原因等内容,欢迎下载使用。










