
高考化学真题和模拟题分类汇编专题09化学能与热能(2份打包,含解析+原卷版,可预览)
展开专题09化学能与热能
2021年化学高考题
一、单选题
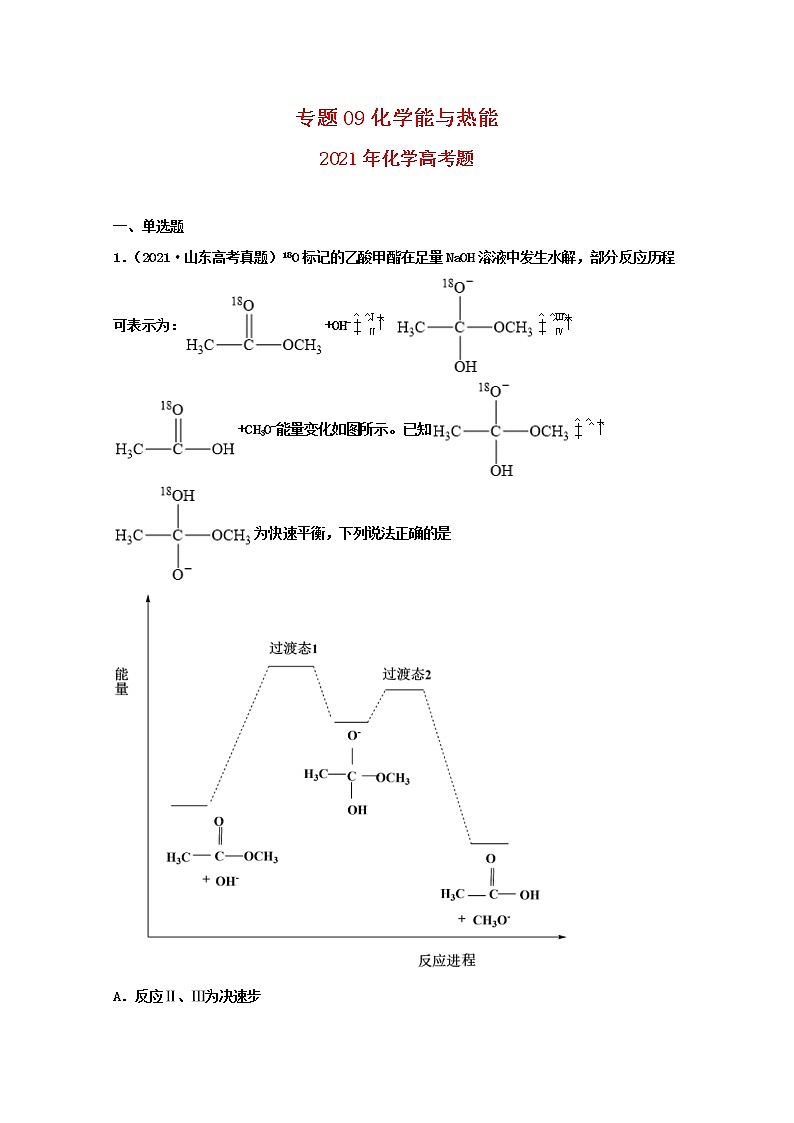
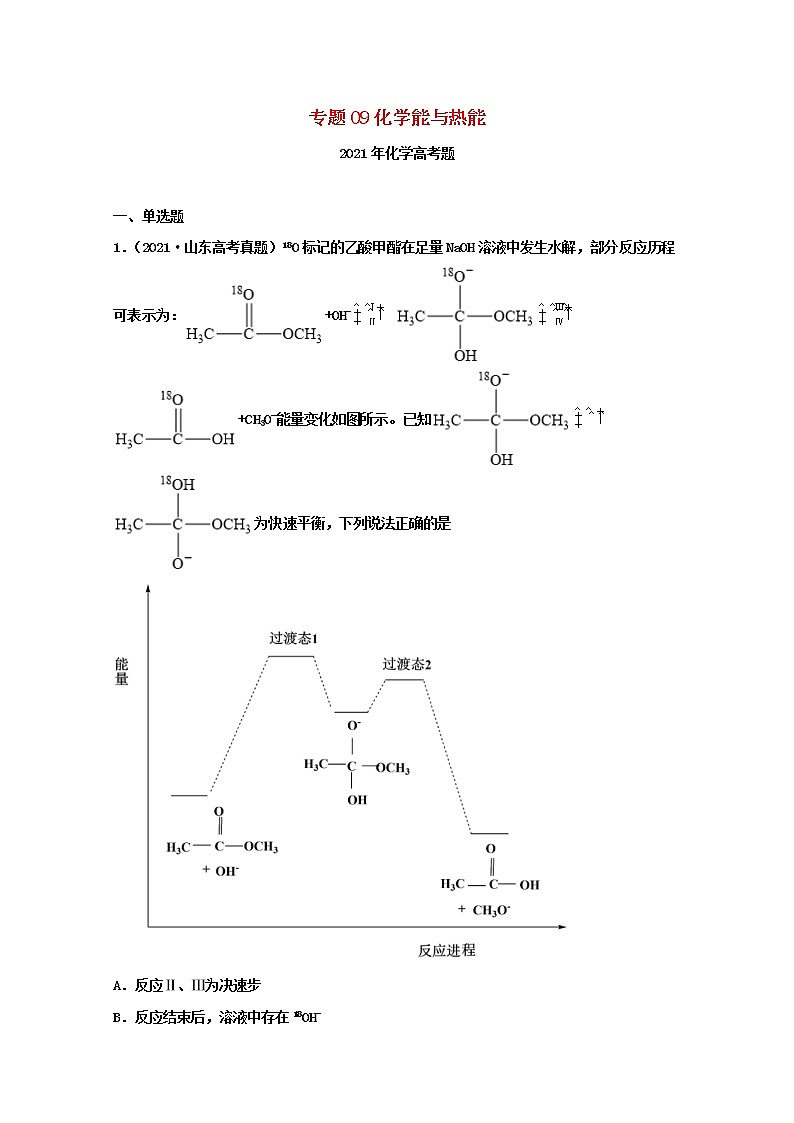
1.(2021·山东高考真题)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
2.(2021·浙江)相同温度和压强下,关于反应的,下列判断正确的是
A. B.
C. D.
3.(2021·广东高考真题)“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是
A.煤油是可再生能源
B.燃烧过程中热能转化为化学能
C.火星陨石中的质量数为20
D.月壤中的与地球上的互为同位素
4.(2021·河北高考真题)下列操作规范且能达到实验目的的是
A.图甲测定醋酸浓度 B.图乙测定中和热
C.图丙稀释浓硫酸 D.图丁萃取分离碘水中的碘
5.(2021·浙江高考真题)已知共价键的键能与热化学方程式信息如下表:
共价键
H- H
H-O
键能/(kJ·mol-1)
436
463
热化学方程式
2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1
则2O(g)=O2(g)的ΔH为
A.428 kJ·mol-1 B.-428 kJ·mol-1 C.498 kJ·mol-1 D.-498 kJ·mol-1
6.(2021·浙江高考真题)在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1,N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是
A. B.
C. D.
二、原理综合题
7.(2021·湖南高考真题)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将分解为和。回答下列问题:
(1)反应_______;
(2)已知该反应的,在下列哪些温度下反应能自发进行?_______(填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,时反应达到平衡,用的浓度变化表示时间内的反应速率_______(用含的代数式表示)
②时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后分压变化趋势的曲线是_______(用图中a、b、c、d表示),理由是_______;
③在该温度下,反应的标准平衡常数_______。(已知:分压=总压×该组分物质的量分数,对于反应,,其中,、、、为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
(4)电解过程中的移动方向为_______(填“从左往右”或“从右往左”);
(5)阳极的电极反应式为_______。
KOH溶液KOH溶液
2021年化学高考模拟题
一、单选题
1.(2021·九龙坡区·重庆市育才中学高三三模)工业合成三氧化硫的反应为2SO2(g)+O2(g)2SO3(g) ΔH=-198kJ·mol-1,反应过程可用下图模拟(代表O2分子,代表SO2分子,代表催化剂)。下列说法不正确的是
A.过程Ⅱ和过程Ⅲ决定了整个反应进行的程度
B.过程Ⅱ为吸热过程,过程Ⅲ为放热过程
C.加入SO2和O2各1mol,充分反应后放出的热量小于99KJ
D.催化剂可降低反应的活化能,使ΔH减小
2.(2021·重庆市第十一中学校高三二模)文献报道:在45 ℃、0.1 MPa时,科学家以铁粉为催化剂,通过球磨法合成氨。部分反应历程如图所示(吸附在催化剂表面的物种用*标注),下列说法正确的是
A.由此历程可知:N*+3H*=NH*+2H* ΔH>0
B.铁粉改变了合成氨的反应历程和反应热
C.图示过程中有极性共价键的生成
D.用不同催化剂合成氨,反应历程均与上图相同
3.(2021·青海高三三模)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢[C2H4(g)+H2(g)=C2H6(g) △H=a mol·L-1]的反应历程如下图所示:
下列说法正确的是
A.该反应为吸热反应 B.a=-129.6
C.催化乙烯加氢效果较好的催化剂是AuF D.两种过渡态物质中较稳定的是过渡态1
4.(2021·全国高三零模)科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,一个分子还原的能量变化与反应历程如图所示。下列说法错误的是
A.该反应的热化学方程式为
B.决定整个反应速率快慢的步骤是①
C.反应过程中断裂与形成的化学键都包含键和键
D.改变催化剂,不能使反应的焓变发生改变
5.(2021·陕西宝鸡市·)2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是
A.升高温度不能提高一段时间内的产率
B.图①→②过程吸热,图②→③过程放热
C.在反应过程中三键均发生断裂
D.反应过程中存在、等中间产物
6.(2021·安徽高三一模)马里奥·莫利纳等科学家通过研究揭示了大气中臭氧层被破坏的机理,如图所示。下列说法错误是
A.CFCl3是四面体结构
B.过程Ⅲ中的O原子可能来自大气中O2或O3的解离
C.整个过程中,CFCl3是O3分解的催化剂
D.紫外线辐射提供破坏化学键的能量
7.(2021·浙江高三其他模拟)反应A+B→C分两步进行:反应①A+B→X,反应②X→C。反应过程中能量变化如图,下列说法正确的是
A.该反应为放热反应,△H=a-d
B.催化剂通过降低化学反应的焓变加快化学反应速率
C.升高温度,a、b、c、d的数值均会发生改变
D.该反应速率的快慢主要由反应②决定
8.(2021·广西南宁市·南宁三中高三三模)为应对全球气候问题,中国政府承诺“2030 年碳达峰”、“2060 年碳中和”。科学家使用络合物作催化剂,用多聚物来捕获二氧化碳,反应可能的过程如图所示。下列叙述错误的是
A.该反应若得以推广将有利于碳中和
B.反应过程中只有极性键的断裂和形成
C.总反应方程式为CO2 +3H2CH3OH + H2O
D.开发太阳能、风能等再生能源可降低CO2、CH4温室气体的碳排放
9.(2021·长沙市明德中学高三三模)Ni可活化C2H6放出CH4,其反应历程如下图所示:
下列关于活化历程的说法错误的是
A.此反应的决速步骤:中间体2→中间体3
B.只涉及极性键的断裂和生成
C.在此反应过程中Ni的成键数目发生变化
D.Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) ∆H=−6.57 kJ·mol-1
10.(2021·北京高三其他模拟)Deacon催化氧化法将HCl转化为Cl2的反应为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)ΔH=-116kJ·mol-1
研究发现CuCl2(s)催化反应的过程如下:
反应i:CuCl2(s)=CuCl(s)+Cl2(g)ΔH1=+83kJ·mol-1
反应ii:CuCl(s)+O2(g)=CuO(s)+Cl2(g)ΔH2=-20kJ·mol-1
反应iii:……
下列表述不正确的是
A.反应i中反应物的总能量小于生成物的总能量
B.反应ii中,1molCuCl(s)反应时转移2mole-
C.推断反应iii应为CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)ΔH3=-242kJ·mol-1
D.由反应过程可知催化剂参与反应,通过改变反应路径提高反应速率
11.(2021·河南新乡市·新乡县一中高三其他模拟)CH3-CH=CH-COOCH3有两种立体异构体和,由CH3CHO和Ph3P=CHCOOCH3反应制取这两种异构体的历程中能量变化如图
已知:在立体结构中,实线表示该键在纸平面上,实楔形线表示该键在纸前方,虚线表示该键在纸后方。
下列说法正确的是
A.比稳定
B.温度升高,CH3CHO的转化率减小
C.生成的过程中,速率最快的是由生成的反应
D.两个反应历程中,中间产物相同
12.(【一飞冲天】4.实验中学一模)CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步为①N2O+Fe+=N2+FeO+(慢)、②FeO++CO=CO2+Fe+(快)。下列说法正确的是
A.分子构型:CO2为直线型,N2O为V形(已知N2O中每个原子都满足8电子稳定结构)
B.反应①的活化能比反应②大
C.反应中每转移1mol电子,生成N2体积为11.2L
D.两步反应均为放热反应,总反应的化学反应速率由反应②决定
13.(2021·阜新市第二高级中学高三其他模拟)CO2是廉价的碳资源,将其甲烷化具有重要意义。其原理是CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH<0.在某密闭容器中,充入1molCO2和4molH2发生上述反应,下列叙述正确的是
A.反应物的总能量小于生成物的总能量
B.升高温度可增大活化分子的百分数及有效碰撞频率,因而温度越高越利于获得甲烷
C.恒温、恒压条件下,充入He,平衡向正反应方向移动
D.在绝热密闭容器中进行时,容器中温度不再改变,说明已达到平衡
14.(2021·阜新市第二高级中学高三其他模拟)在含有Fe3+、S2O和I-的混合溶液中,反应S2O(aq)+2I-(aq)=2SO(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O(aq)+2Fe2+(aq)=2SO(aq)+2Fe3+(aq)
下列关于该反应的说法错误的是
A.Fe3+是该反应的催化剂
B.步骤②比步骤①速率快
C.该反应为放热反应
D.若不加Fe3+,则正反应的活化能比逆反应的大
15.(2021·长沙市明德中学高三三模)我国研究人员研发了一种新型纳米催化剂,实现CO2和H2反应得到CH4,部分微粒转化过程如图(吸附在催化剂表面上的物种用*标注)。下列说法不正确的是
A.过程②吸收热量
B.过程③涉及极性键的断裂和形成
C.结合过程③,过程④的方程式为*C+2*OH+6H→CH4+2H2O
D.整个过程中制得1molCH4转移电子的物质的量为6mol
16.(2021·天津高三一模)正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(a)随温度变化如图所示。
名称
熔点/℃
沸点/℃
燃烧热ΔH/kJ·mol-1
正戊烷
-130
36
-3506.1
异戊烷
-159.4
27.8
-3504.1
下列说法不正确的是
A.正戊烷异构化为异戊烷反应的ΔH<0
B.28~36℃时,随溫度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动
C.寻找更好的催化剂可使正戊烷异构化为异戊烷的转化率大大提升
D.150℃时,体系压强从100kPa升高到500kPa,正戊烷的平衡转化率基本不变
17.(2021·天津高三一模)如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是
A.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
B.第一步反应的速率小于第二步反应
C.总反应为放热反应
D.升高温度,Ea1、Ea2均增大,反应速率加快
二、原理综合题
18.(2021·安徽高三一模)甲醇是目前人类认知最为安全、高效、清洁的替代燃料,可用如下方法制备:碳的氧化物和氢气合成法,其主要反应包括:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H1=—90.8kJ•mol—1
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=—49.0kJ•mol—1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) △H3
(1)在恒温的合成塔中发生上述反应,达到平衡时合成塔出口处总压强为5.0MPa,各组分的体积分数如表所示:
CO
CO2
H2
CH3OH
其他
10.0%
5.0%
50.0%
2.5%
32.5%
①反应Ⅲ的焓变△H3=___。
②此温度下反应Ⅰ的平衡常数Kp=___(MPa)—2。
(2)反应Ⅰ是合成甲醇的主要反应,在二氧化碳存在时,单位体积催化剂上生成甲醇的速率如图:
①加入二氧化碳对甲醇反应速率的影响是___。
②在无二氧化碳的体系中加入适量氧气也可以起到和二氧化碳相似的作用,原因是___。
(3)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。
①该反应历程中控速步骤的能垒为___eV。
②写出虚线框内发生的化学反应方程式___。
19.(2021·四川成都市·成都七中)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:。下图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:可知该反应在___________(高温或低温)条件下能自发进行。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K (400℃)=___________(列出计算式)。
按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是___________。
(2)Deacon直接氧化法可按下列催化过程进行:
△H1=83 kJ·mol-1
则的______
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是___________(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有___________(写反应方程式)。电路中转移1mol电子,需消耗氧气___________L(标准状况)。
20.(2021·河南新乡市·新乡县一中高三其他模拟)在一定条件下,由CO2和H2合成甲醇已成为现实,该合成对解决能源问题具有重大意义。该过程中有两个竞争反应,反应过程能量关系如图。
(1)请写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式为___________。
(2)对于CO2(g)+3H2(g)CH3OH(g)+H2O(g)反应,已知v正=k正c(CO2)c3(H2),v逆=k逆c(CH3OH)c(H2O),升高温度k正增大的倍数___________k逆增大的倍数(填“<”、“>”或“=”),为了提高H2的转化率,可采取的措施有___________(填选项)。
A.加压B.升温C.加催化剂D.增加CO2的浓度
(3)在一容积可变的密闭容器中,充入1molCO2与3molH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),CO2在不同温度下的平衡转化率与总压强的关系如下图所示,图中M点时CH3OH的物质的量分数为___________,该反应的压强平衡常数为Kp=___________atm-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)由CO2和H2合成甲醇有两个竞争反应,为提高CH3OH的选择性,在原料气中掺入一定量CO,原因是___________。另外,可以通过控制双组份催化剂(CuO-ZnO)中CuO的含量,可提高甲醇产率,根据下图判断,催化剂选择性最好的CuO的含量为___________。
21.(2021·天津)氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)已知部分化学键的键能如表
化学键
N≡N
H —H
N—H
键能/(kJ·mol-1)
946
436
391
工业上合成氨反应当过程中转移3 mol电子时,理论上热量变化为 ___________kJ。
(2)在一个恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g)发生反应:2NO(g)+Cl2(g) 2ClNO(g) 在一定温度下测得NO的物质的量(单位:mol)与时间的关系如表所示:
t/min
0
5
8
13
NO的物质的量
2
1.15
1.0
1.0
①测得该反应平衡常数与温度关系为1gKp=5.08+ ,则该反应是___________(填“吸热”或“放热”反应)。
②同温度下,起始时容器内的压强为P0,则该反应的平衡常数KP=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若同温度下,在相同容器中,充入1 mol NO(g)和0.5 molCl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)。
(3)某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生反应4NH3(g)+6NO(g)5N2(g)+6H2O(l);NO的转化率随温度变化的情况如图。5 min内,温度从420 K升高到580 K,此时段内NO的平均反应速率v(NO)___________,420 K之前,NO生成N2的转化率偏低的原因可能是___________。
(4)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,A电极的电极反应式为___________。
22.(2021·天津高三二模)氮的化合物在生产实践及科学研究中应用广泛
(1)目前工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
2NH3(1)+H2O(1)+CO2(g)(NH4)2CO3(aq)K1
NH3(l)+H2O(1)+CO2(g)NH4HCO3(aq)K2
(NH4)2CO3(aq)+H2O(1)+CO2(g)2NH4HCO3(aq)K3
则K3=___(用含K1、K2的代数式表示)。
(2)利用CO2制备乙烯是我国能源领域的一个重要战略方向,具体如下:CO2催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g)C2H4(g)+4H2O(g);ΔH=akJ·mol-1。起始时按n(CO2):n(H2)=1:3的投料比充入20L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
①a___0(选填“>”或“<”)。
②下列说法正确的是___(填字母序号)。
A.使用催化剂,可降低反应活化能,加快反应速率
B.其它条件不变时,若扩大容器容积,则v正减小,v逆增大
C.测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,则将___(填“变大”、“不变”或“变小”)。
(3)N2H4为二元弱碱,在水中的电离方程式与氨相似,常温下,向10mL0.1mol/L的联氨溶液中,滴加0.1mol/L的HCl溶液xmL溶液中N2H4、N2H、N2H的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示。
①25℃时,写出N2H4在水中第一步电离方程式___。
②25℃时,N2H4在水中的第二步电离常数值为___。
③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:___。
23.(2021·长沙市明德中学高三三模)CH4—CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H>0]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。
(1)相关物质的燃烧热数据如下表所示:
物质
CH4(g)
CO(g)
H2(g)
燃烧热(kJ·mol-1)
890.3
283.0
285.8
ΔH=_______kJ·mol-1。
(2)该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
①对积炭反应进行计算,得到温度和压强对积炭反应中平衡炭量的影响图(图a和图b),其中表示温度和压强对CH4的裂解反应中平衡炭量影响的是(选填序号)_______,理由是_______。
②实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由_______反应产生。
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
(3)该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
①该反应可以储能的原因是_______。
②某条件下,研究者研究反应物气体流量、物质的量比()对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
序号
加热温度/℃
反应物气体流量/L·min-1
XCH4/%
ηchem/%
①
800
4
2:2
79.6
52.2
②
800
6
3:3
64.2
61.9
③
800
6
2:4
81.1
41.6
(资料)储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
a.对比实验_______(填序号),可得出结论:气体流量越大,CH4转化率越低。
b.对比实验②和③发现,混合气中CO2占比越低,储能效率越高,原因可能是_______(该条件下设备的加热功率Q视为不变)。
24.(2021·青龙满族自治县第一中学高三其他模拟)2020年9月,习近平主席在第75届联合国大会提出我国要实现2030年前碳达峰、2060年前碳中和的目标。因此CO2的捕集、利用与封存成为科学家研究的重要课题。
I.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ∆H
(1)一定压强下,由最稳定单质生成1mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395kJ·mol-1、-74.9kJ·mol-1、-110.4kJ·mol-1则上述反应的∆H=_______kJ·mol-1
(2)此反应的活化能Ea(正)_______Ea(逆)(填“>”、“=”或“<”),利于反应自发进行的条件是_______(填“高温”或“低温”)。
(3)一定温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为14kPa、16kPa,一段时间达到平衡后,测得体系压强是起始时的1.4倍,则该反应的平衡常数Kp=_______(kPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于反应CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) ∆H=-165kJ·mol-1,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示。
(4)高于320℃后,以Ni-CeO2为催化剂,CO2转化率略有下降,而以Ni为催化剂,CO2转化率却仍在上升,其原因是_______。
(5)对比上述两种催化剂的催化性能,工业上应选择的催化剂是_______,使用的合适温度为_______。
25.(2021·天津和平区·耀华中学高三二模)近年来我国在环境治理上成效斐然。回答下列问题:
(1)CH4还原氨氧化物使其转化为无毒气体,部分反应的热化学方程式及活化能(E)如下:
i.CH4(g)+4NO2(g)=4NO(g)+2H2O(g)+CO2(g) ΔH1=-574kJ·mol-1 E1=1274kJ·mol-1;
ii.CH4(g)+4NO(g)=2N2(g)+2H2O(g)+CO2(g) ΔH2=-1160kJ·mol-1 E2=493kJ·mol-1。
①反应CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ΔH3=_______kJ·mol-1
②相同条件下,反应i比反应ii的速率慢,理由为_______。
(2)探究催化剂条件下CO和NO的处理,反应原理为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH4。向某密闭容器中充入等物质的量的CO和NO,不同条件下NO的平衡转化率如图1所示:
①下列事实能说明该反应达到平衡状态的是_______(填选项字母)。
a.CO和NO的转化率相等
b.NO和N2的总物质的量不再发生变化
c.CO和CO2的总物质的量不再发生变化
②ΔH4_______0(填“>”或“<”,下同,p1_______p2。
(3)最近我国科学家设计了一种电解法处理污染气体中NOx的高效去除装置,如图2所示,其中电极分别为催化剂石墨烯(石墨烯包裹催化剂)和石墨烯。
①催化剂石墨烯为_______极(填“阴”或“阳”)。
②若电解质溶液显酸性,则催化剂石墨烯电极的电极反应式为_______。
(4)燃煤烟气脱硫的方法有多种。其中有种方法是用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,向NH4HSO3溶液中通空气氧化的离子反应方程式_______。已知H2SO3的Ka1=1.3×10-2、Ka2=6.2×10-8。常温下,将SO2通入某氨水至溶液恰好呈中性,此时溶液中=_______。
26.(【一飞冲天】6.芦台一中一模)碳的化合物在工业上应用广泛,下面对几种碳的化合物的具体应用进行分析对“碳中和”具有重要意义。
(1)已知下列热化学方程式:
i.CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3(g) ΔH1=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g) ΔH2=-100kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)CH2ClCHClCH3(g)的正反应的活化能Ea(正)为132kJ·mol-1,则逆反应的活化能Ea(逆)为___kJ·mol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第①步反应为CH3CHO(aq)+I2(aq)=CH3I(l)+HI(aq)+CO(g)(慢反应);
第②步为快反应;增大I2的浓度能明显增大总反应的平均速率。理由为___。
(3)工业上可利用煤的气化产物(水煤气)合成甲醇:CO(g)+2H2(g)CH3OH(g)ΔH<0,在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①下列描述能说明该反应处于化学平衡状态的是___(填字母)。
A.CO的体积分数保持不变
B.容器中CO的转化率与H2的转化率相等
C.v逆(CH3OH)=2v逆(H2)
D.容器中混合气体的平均相对分子质量保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
③X轴上a点的数值比b点___(填“大”或“小”),某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(4)甲醇与CO可以生成醋酸,常温下将amol/L的醋酸与bmol·L-1Ba(OH)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),则醋酸的电离平衡常数为_____(忽略混合过程中溶液体积的变化,用含a和b的代数式表示)。
27.(2021·天津高三三模)我国在碳—1化学方面的进展主要集中在合成气化工和甲醇化工。
I.研究CO2与CH4反应使之转化为CO和H2(合成气),可减缓燃料危机和减弱温室效应,过程包括
反应a:CH4(g)+CO2(g)2CO(g)+2H2(g)△H1>0
反应b:H2(g)+CO2(g)H2O(g)+CO(g)△H2>0
(1)反应a在一定条件下能够自发进行的原因是___;该反应工业生产适宜的温度和压强为___(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2平衡转化率随温度变化关系如图所示。
①923K时CO2的平衡转化率大于CH4的原因是___。
②计算923K时反应b的化学平衡常数K=____(计算结果保留小数点后两位)。
II.CO2催化加氢制甲醇:在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示。
(3)下列说法正确的是___。
A.该反应的正反应为放热反应
B.压强大小关系为P1
D.在P2及512K时,图中N点v(正)
(4)H2CO3电离常数为:Ka1=4×10-7,Ka2=4×10-11。已知0.1mol/LNH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是___(填序号)。
A.c(NH)+c(NH3·H2O)+c(H+)=c(HCO)+c(CO)+c(H2CO3)+c(OH-)
B.c(NH)+c(NH3·H2O)=c(HCO)+c(H2CO3)
C.c(H2CO3)-c(CO)-c(NH3·H2O)=9.9×10-7mol·L-1
D.等体积等物质的量浓度NH4HCO3与NaCl溶液混合析出晶体,静置上层清液存在:c(H+)+c(NH)>c(OH-)+c(HCO)+2c(CO)
②c(H2CO3):c(CO)=___(结果保留三位有效数字)。
28.(2021·四川雅安市·高三三模)在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应
正反应活化能
逆反应活化能
t℃时平衡常数
N2(g)+O2(g)=2NO(g) ∆H>0
akJ∙mol-1
bJ∙mol-1
K1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0
eJ∙mol-1
dJ∙mol-1
K2
请写出t℃时NH3被NO氧化生成无毒气体的热化学方程式_______(反应热用a、b、e、d代数式表示)。t℃该反应的平衡常数为_______(用K1和K2表示)。请解释该反应能否自发进行_______。
(2)一定温度下,将2molN2和6molH2置于1L的恒容密闭容器中发生如下反应:
N2(g)+3H2(g)⇌2NH3(g) △H<0。测得不同条件、不同时间段内合成氨反应中N2的转化率,数据如下:
1小时
2小时
3小时
4小时
T1
30%
50%
80%
80%
T2
35%
60%
a
b
①上表中T1_______T2(“>”“ <”或“=”表示),其中a、b、80%三者的大小关系是_______(用含“>”“<”或“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为v=,k为速率常数。以下说法正确的是_______(填字母)
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为17且保持不变,则反应达到平衡状态
C.将原容器中的NH3及时分离出来可使v增大
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大。
③已知某温度下该反应达平衡时各物质均为1mol,容器容积为1L,保持温度和压强不变,又充入3molN2后,平衡_______(填“向左移动”“向右移动”或“不移动”)。
29.(2021·四川达州市·高三二模)氮及其化合物在生产、生活与环境中有着重要研究和应用价值。根据要求回答问题:
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=_______kJ·mol-1
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)_______(填“增大”、“不变”或“减小”)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=_______mol/(L·s)
③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=,则该温度下该反应平衡转化率α(N2O4)=_______,保持温度不变,再向密闭容器中充入nmolN2O4,维持总压强为2p0,则在该温度下该反应的压强平衡常数(Kp)=_______(用各气体物质的分压代替浓度的平衡常数叫压强平衡常数(Kp)。分压=总压×物质的量分数)
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
V(HN3)/mL
0
12.50
12.75
25.00
pH
13
9
7
a
①pH=9时溶液中c(N)_______c(R+)(填“>”、“=”或“<”),pH=a时溶液中c(HN3)_______c(N)(填“大于”“等于”或“小于”)
②HN3的Ka=_______(精确值)
(4)N2O5是一种新型硝化剂。其制备装置如图所示。
透过隔膜的粒子是_______,制取N2O5的电极反应式为_______
三、填空题
30.(2021·阜新市第二高级中学高三其他模拟)SO2、NOx是主要的空气污染源,需经过处理才能排放。回答下列问题:
(1)二氧化硫在V2O5作用下的催化氧化是工业上产生硫酸的主要反应。催化反应的机理是:
第一步:SO2(g)+V2O5(s)=SO3(g)+V2O4(s) ΔH=+akJ•mol-1
第二步:V2O4(s) +O2(g)+2SO2(g)=2VOSO4(s) ΔH=-bkJ•mol-1
第三步:4VOSO4(s)+O2(g)=2V2O5(s)+4SO3(g) ΔH=-ckJ•mol-1
请写出二氧化硫催化氧化的热化学方程式___________。
(2)一定条件下,用Fe2O3作催化剂对燃煤烟气进行回收。反应为2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH<0.80℃时,在容积恒为1L的密闭容器中投入总物质的量为2mol的气体,按n(CO):n(SO2)为1:1或3:1投料时SO2转化率的变化情况如图。则图中表示n(CO):n(SO2)=1:1的变化曲线为___________(填字母),若曲线bSO2的平衡转化率是42%,用SO2表示30min内的平均反应速率是___________。CO2和SO2的中心原子杂化方式分别为______,_____。
(3)一定温度下,在容积恒为1L的密闭容器中,充入0.3molNO与过量的金属Al,发生的反应存在如下平衡:Al(s)+2NO(gN2(g)+Al2O3(s) ΔH<0.已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系(k1、k2为速率常数):v(NO)=k1•c2(NO),v(N2)=k2•c(N2)。
①在T1温度下,k1=0.004L•mol•min-1,k2=0.002min-1,该温度下反应的平衡常数的值为______。
②T2温度下,NO的物质的量随时间的变化如图,其平衡常数的值为___________;温度T1___________T2(填“小于”“等于”或“大于”),判断理由是___________。
高考化学真题和模拟题分类汇编专题20工业流程题(2份打包,含解析+原卷版,可预览): 这是一份高考化学真题和模拟题分类汇编专题20工业流程题(2份打包,含解析+原卷版,可预览),文件包含高考化学真题和模拟题分类汇编专题20工业流程题含解析doc、高考化学真题和模拟题分类汇编专题20工业流程题原卷版doc等2份试卷配套教学资源,其中试卷共130页, 欢迎下载使用。
高考化学真题和模拟题分类汇编专题17有机化学基础(2份打包,含解析+原卷版,可预览): 这是一份高考化学真题和模拟题分类汇编专题17有机化学基础(2份打包,含解析+原卷版,可预览),文件包含高考化学真题和模拟题分类汇编专题17有机化学基础含解析doc、高考化学真题和模拟题分类汇编专题17有机化学基础原卷版doc等2份试卷配套教学资源,其中试卷共65页, 欢迎下载使用。
高考化学真题和模拟题分类汇编专题13盐类的水解(2份打包,含解析+原卷版,可预览): 这是一份高考化学真题和模拟题分类汇编专题13盐类的水解(2份打包,含解析+原卷版,可预览),文件包含高考化学真题和模拟题分类汇编专题13盐类的水解含解析doc、高考化学真题和模拟题分类汇编专题13盐类的水解原卷版doc等2份试卷配套教学资源,其中试卷共71页, 欢迎下载使用。












