






高中人教版 (2019)第一节 电离平衡课堂教学ppt课件
展开盐酸和醋酸是生活中经常用到的酸。 盐酸常用于卫生洁具的清洁。比如洁厕灵的有效成分是盐酸。 我们知道醋酸的腐蚀性比盐酸的小,比较安全,为什么不用醋酸代替盐酸?
电解质:在水溶液中或熔融状态下能导电的化合物
电离:电解质溶于水或受热融化时,形成自由移动的离子的过程
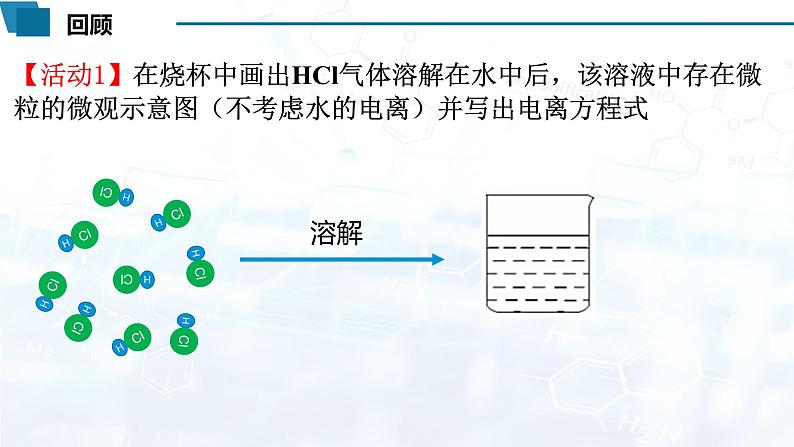
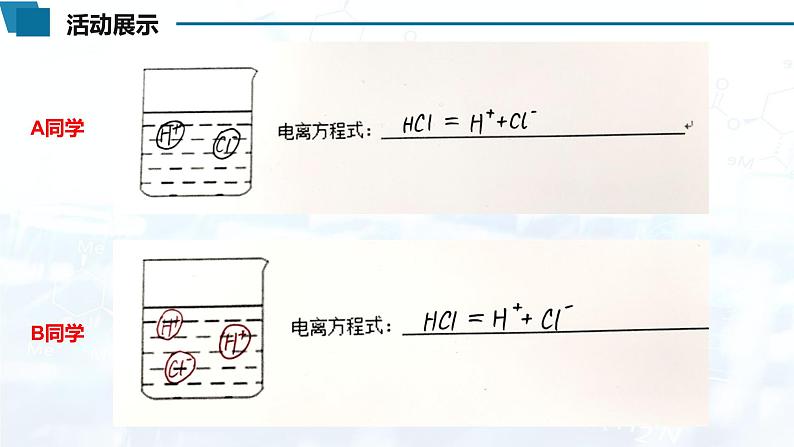
【活动1】在烧杯中画出HCl气体溶解在水中后,该溶液中存在微粒的微观示意图(不考虑水的电离)并写出电离方程式
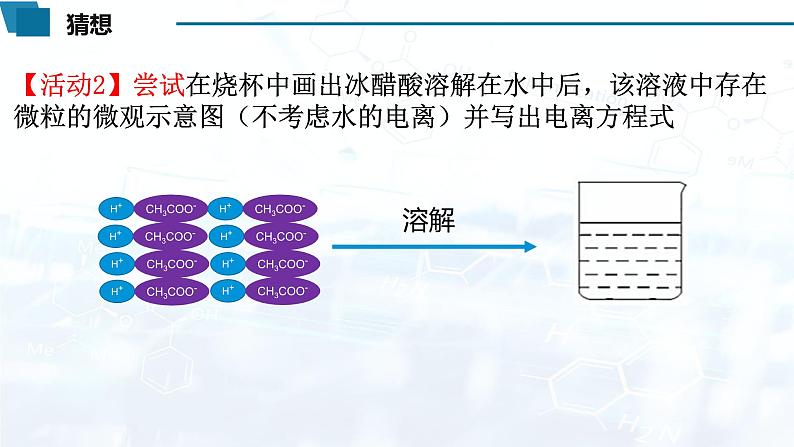
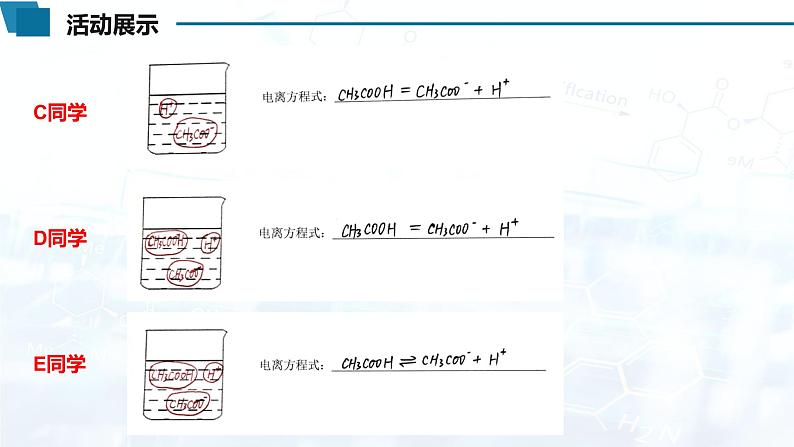
【活动2】尝试在烧杯中画出冰醋酸溶解在水中后,该溶液中存在微粒的微观示意图(不考虑水的电离)并写出电离方程式
【实验1】取相同体积、0.1ml/L的盐酸和醋酸分别与等量的镁条反应,观察、比较并记录现象。
能否从化学反应速率的角度来解释该现象产生的原因?
Mg+2HCl==MgCl2+H2↑
Mg+2HAc==MgAc2+H2↑
原因:等浓度的盐酸和醋酸溶液中c(H+)盐酸 > c(H+)醋酸
【实验2】取相同体积、0.1ml/L的盐酸和醋酸,比较它们pH的大小
0.1ml/L盐酸中c(H+)=0.1ml/L
0.1ml/L醋酸中c(H+)=0.001ml/L
大约每100个CH3COOH只有1个CH3COOH发生电离
电解质(HCl)电离的结果
电解质(CH3COOH)电离的结果
强电解质:在水中全部电离的电解质
弱电解质:在水中部分电离的电解质(微弱电离)
CH3COOH CH3COO-+H+
HCl H++Cl-
用“ ” 代表完全电离
用“ ” 代表微弱电离
H2CO3 H++HCO3- 、 HCO3- H++CO32-
2. Fe(OH)3 Fe3++3OH-
3. NaHCO3 Na++HCO3- 、 HCO3- H++CO32-
多元弱碱也是分步进行,但是一般按一步电离的形式书写
1. H2CO3电离方程式书写
【活动3】尝试写出以下物质在水溶液中的电离方程式1.NH3·(OH)
NH4+ + OH-
Fe3+ + 3OH-
Na+ + HSO3-
HS- H++S2-
Na+ + H++ SO42-
HSO3- H++SO32-
NaHSO4 Na++H++SO42-
NaHSO4 (熔融) Na++HSO4-
在熔融状态电离,熔融状态下共价键不发生断裂
Al2O3 (熔融) 2Al3++3O2-
NaCl (熔融) Na++Cl-
【提问1】H+与CH3COO-会结合生成醋酸吗?
【实验3】常温下,向0.1ml/LCH3COOH溶液中不断加入中性的CH3COONH4固体,用pH传感器测量溶液的pH的变化,实时呈现pH随时间变化的图像
加入CH3COONH4(s)
pH随着中性CH3COONH4固体的增加而不断增大
CH3COO-+H+ CH3COOH
CH3COOH CH3COO-+H+
电离过程是可逆的,故存在电离平衡。
左→右:弱电解质电离成离子右←左:离子结合成弱电解质
【活动4】根据化学平衡方面知识,尝试画出冰醋酸电离过程中的v-t曲线
同浓度条件下盐酸中的c(H+)大于醋酸中c(H+),浓度越大,反应速率越快,去污速率越快。
CaCO3+2H+ Ca2++CO2↑+H2O
概念强电解质:全部电离 (强酸、强碱、大部分盐)②弱电解质:部分电离(弱酸、弱碱、H2O)
电离方程式书写多元弱酸分步电离多元弱碱一般按一步电离书写弱酸酸式盐先完全电离,酸式酸根再分步电离
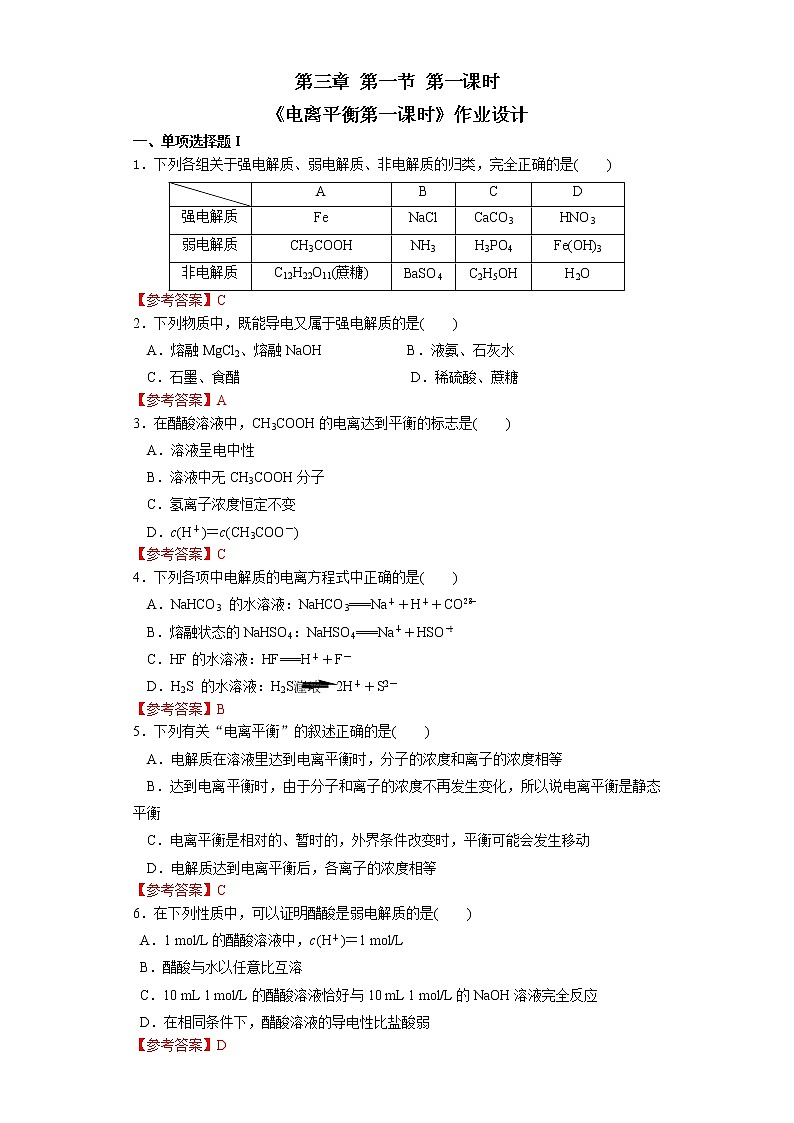
1.下列物质前者是强电解质、后者是弱电解质的是( )A.KNO3 CH3COOH B.HCl NaHSO4C.NaCl BaSO4 D.NH3·H2O H2SO4
2.下列物质在水溶液中的电离方程式正确的是( )A.H2SO4===H++SO42- B.CH3COOH===CH3COO-+H+C.NaHSO4===Na++HSO42- D.2H2O H3O++OH-
3.下列说法正确的是( )A.HR溶液的导电性较弱,HR属于弱酸B.某化合物溶于水导电,则该化合物为电解质C.根据电解质在其水溶液中能否完全电离,将电解质分为强电解质和弱电解质D.食盐是电解质,食盐的水溶液也是电解质
4.醋酸是电解质,下列能说明醋酸的是( )A. 醋酸与水能以任意比例互溶B. 0.1 ml·L-1醋酸的pH比0.1 ml·L-1的盐酸的pH大C. 蛋壳浸入白醋中有气体放出D. 大小相同的锌粒与盐酸和醋酸反应,醋酸产生H2的速率慢
5.【双选】c(H+)相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,则下列说法正确的是( )A.反应开始时的速率:甲>乙B.反应结束时的c(H+):甲<乙C.反应开始时的酸的物质的量浓度:甲=乙D.反应所需时间:甲>乙
高中化学人教版 (2019)选择性必修1第一节 电离平衡教课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡教课课件ppt,共1页。
高中化学人教版 (2019)选择性必修1第一节 电离平衡图片ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡图片ppt课件,共42页。
高中化学第三章 水溶液中的离子反应与平衡第一节 电离平衡精品ppt课件: 这是一份高中化学第三章 水溶液中的离子反应与平衡第一节 电离平衡精品ppt课件,共16页。PPT课件主要包含了学习目标,迅速产生大量气泡,产生气泡相对缓慢,接近3,分组实验,图示模拟电离,强电解质,弱电解质,设计实验,具体物质等内容,欢迎下载使用。













