



(通用版)高考化学一轮复习讲练测第07讲 钠及其重要化合物(精讲)(2份打包,解析版+原卷版,可预览)
展开
这是一份(通用版)高考化学一轮复习讲练测第07讲 钠及其重要化合物(精讲)(2份打包,解析版+原卷版,可预览),文件包含通用版高考化学一轮复习讲练测第07讲钠及其重要化合物精讲解析版doc、通用版高考化学一轮复习讲练测第07讲钠及其重要化合物精讲原卷版doc等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
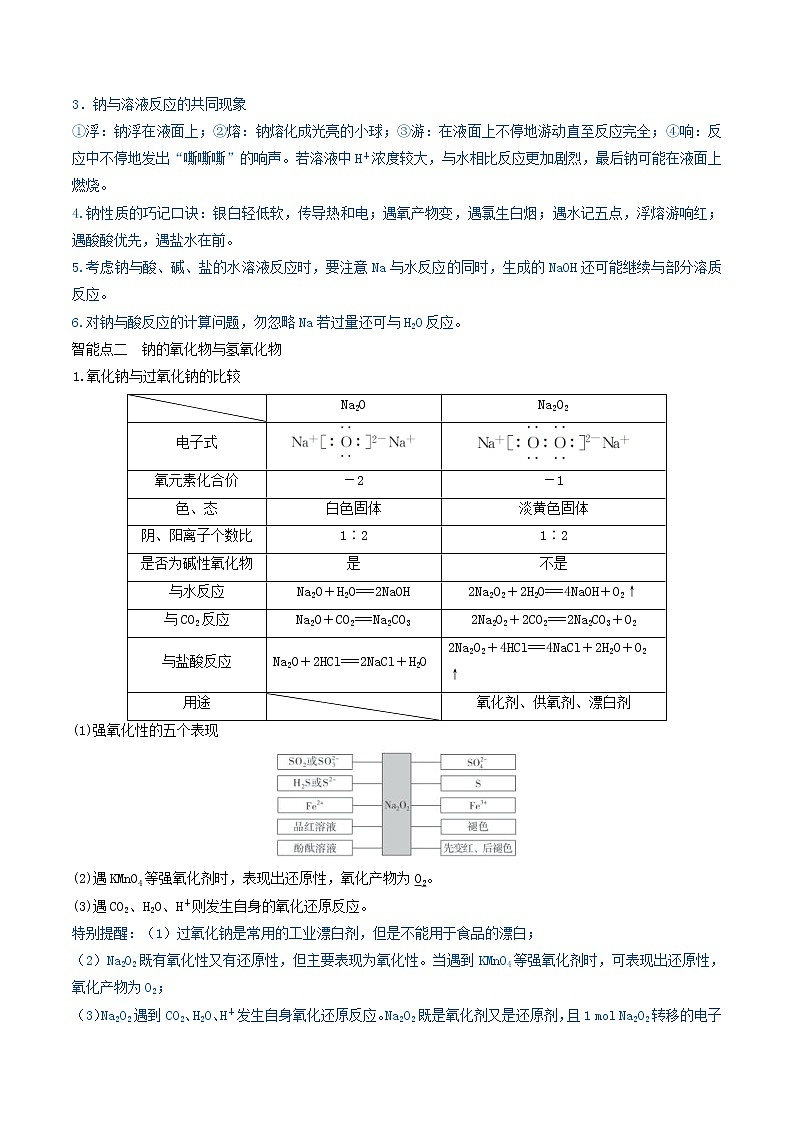
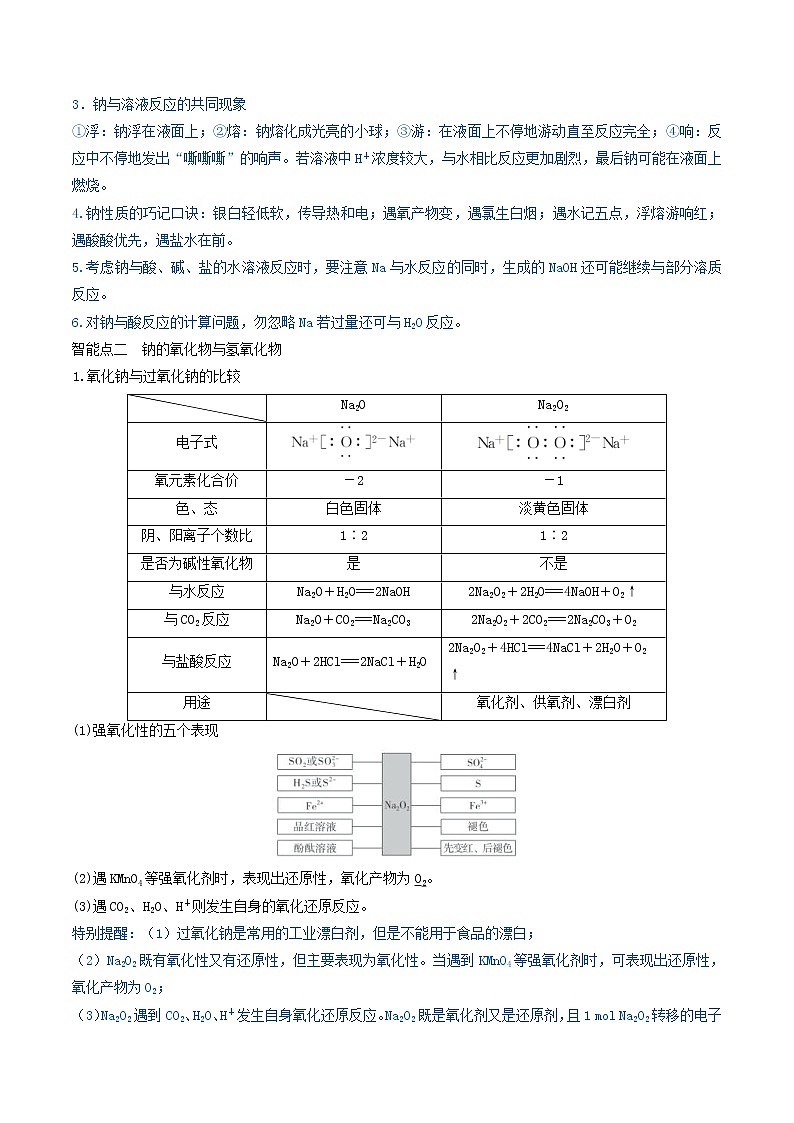
第三章 金属及其化合物第07讲 钠及其重要化合物(精讲)【考情分析】在近几年的高考中,主要以钠及化合物为知识载体考查学生的思维能力、实验能力、计算能力。钠的化合物在日常生活和工农业生产中扮演着重要角色,随着高考试题与社会生活联系的日益密切,钠、过氧化钠的性质,NaHCO3、Na2CO3与酸、碱、盐溶液的反应仍然是高考命题的热点。预计今后仍将以钠及其化合物之间的转化为载体,结合生活、生产及物质的应用,以工业流程题、实验题、选择题和鉴别题等形式出现的可能性较大,也可能出现综合性计算题。【核心素养分析】1.宏观辨识与微观探析:认识钠及其化合物的性质和应用。能从钠的原子结构及其重要化合物的微观结构理解其性质,领悟结构决定性质。2.科学探究与创新意识:了解钠及其化合物的性质探究方案,并积极参与实验探究过程,得出相关结论。【网络构建】【知识梳理】智能点一 钠的性质及应用1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大,即ρ(H2O)>ρ(Na)>ρ(煤油)。2.从钠原子的原子结构认识钠的化学性质——还原性NaNa+(1)与非金属单质(如O2、Cl2)的反应O2:常温:4Na+O2===2Na2O,加热:2Na+O2Na2O2Cl2:2Na+Cl22NaCl(2)与水反应①离子方程式:2Na+2H2O===2Na++2OH-+H2↑。②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na+2H+===2Na++H2↑。(4)与盐反应a.与熔融盐反应如:4Na+TiCl44NaCl+TiNa+KClNaCl+K↑(制取金属钾,因为钾的沸点比钠的沸点低,使钾成为蒸汽而逸出)b.与盐溶液反应Na与CuSO4溶液反应的化学方程式2Na+CuSO4+2H2O===Na2SO4+H2↑+Cu(OH)2↓。(5)与某些有机物反应如:2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑2Na+2CH3COOH―→2CH3COONa+H2↑ 3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)2Na+Cl2↑。(2)保存:密封保存,通常保存在石蜡油或煤油中。4.钠的用途(1)钠钾合金(液态)可用于原子反应堆的导热剂。(2)用作电光源,制作高压钠灯。(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na+TiCl44NaCl+Ti。特别提醒:1.钠燃烧时不能用水灭火,应用沙土盖灭。2.取用金属钠时,用镊子夹取金属钠,用滤纸擦干表面的煤油,放在洁净干燥的玻璃片上用小刀切割,不能用手直接接触金属钠,并且将剩余的钠放回原试剂瓶中保存。3.钠与溶液反应的共同现象①浮:钠浮在液面上;②熔:钠熔化成光亮的小球;③游:在液面上不停地游动直至反应完全;④响:反应中不停地发出“嘶嘶嘶”的响声。若溶液中H+浓度较大,与水相比反应更加剧烈,最后钠可能在液面上燃烧。4.钠性质的巧记口诀:银白轻低软,传导热和电;遇氧产物变,遇氯生白烟;遇水记五点,浮熔游响红;遇酸酸优先,遇盐水在前。5.考虑钠与酸、碱、盐的水溶液反应时,要注意Na与水反应的同时,生成的NaOH还可能继续与部分溶质反应。6.对钠与酸反应的计算问题,勿忽略Na若过量还可与H2O反应。智能点二 钠的氧化物与氢氧化物1.氧化钠与过氧化钠的比较 Na2ONa2O2电子式氧元素化合价-2-1色、态白色固体淡黄色固体阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与水反应Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2↑与CO2反应Na2O+CO2===Na2CO32Na2O2+2CO2===2Na2CO3+O2与盐酸反应Na2O+2HCl===2NaCl+H2O2Na2O2+4HCl===4NaCl+2H2O+O2↑用途 氧化剂、供氧剂、漂白剂(1)强氧化性的五个表现(2)遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。(3)遇CO2、H2O、H+则发生自身的氧化还原反应。特别提醒:(1)过氧化钠是常用的工业漂白剂,但是不能用于食品的漂白;(2)Na2O2既有氧化性又有还原性,但主要表现为氧化性。当遇到KMnO4等强氧化剂时,可表现出还原性,氧化产物为O2;(3)Na2O2遇到CO2、H2O、H+发生自身氧化还原反应。Na2O2既是氧化剂又是还原剂,且1 mol Na2O2转移的电子是1 mol而不是2 mol。(4)Na2O、Na2O2中阴、阳离子个数比均为1∶2。(5)Na2O2与H2O、CO2的反应规律电子转移关系当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-,n(e-)=n(Na2O2)=2n(O2)气体体积变化关系若CO2、水蒸气(或两混合气体)通过足量Na2O2,气体体积的减少量是原气体体积的,等于生成氧气的量,ΔV=V(O2)=V固体质量变化关系CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”,所以固体增加的质量Δm(CO2)=28 g·mol-1×n(CO2)、Δm(H2O)=2 g·mol-1×n(H2O)2.氢氧化钠(1)物理性质:NaOH的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有吸水性;吸收空气中的水分而潮解;有很强的腐蚀性。(2)化学性质①具有碱的通性②其他反应与金属铝反应:2Al+2OH-+2H2O===2AlO+3H2↑与非金属单质反应:Cl2+2OH-===Cl-+ClO-+H2O酯类水解:CH3COOC2H5+NaOHCH3COONa+CH3CH2OH(3)NaOH的制取①土法制碱:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH②现代工业制碱:2NaCl+2H2O2NaOH+H2↑+Cl2↑智能点三 碳酸钠与碳酸氢钠1.物理性质名称碳酸钠碳酸氢钠化学式Na2CO3NaHCO3俗名纯碱或苏打小苏打颜色、状态白色粉末细小白色晶体水溶性易溶于水水中易溶,但比Na2CO3的溶解度小2.化学性质(1)热稳定性①Na2CO3性质稳定,受热难分解。②NaHCO3性质不稳定,受热易分解,化学方程式为2NaHCO3Na2CO3+H2O+CO2↑。(2)与足量盐酸反应的离子方程式①Na2CO3:CO+2H+===H2O+CO2↑。②NaHCO3:HCO+H+===H2O+CO2↑。(3)与碱(NaOH溶液)反应①Na2CO3:与NaOH溶液不反应。②NaHCO3:NaHCO3+NaOH===Na2CO3+H2O。(4)相互转化①Na2CO3―→NaHCO3向Na2CO3溶液中通入CO2,化学方程式为Na2CO3+H2O+CO2===2NaHCO3。②NaHCO3―→Na2CO3NaHCO3固体加热分解转化成Na2CO3。3.Na2CO3和NaHCO3性质的应用(1)Na2CO3、NaHCO3的鉴别①固体的鉴别用加热法:产生使澄清石灰水变浑浊的气体的是NaHCO3固体。②溶液的鉴别可用沉淀法、气体法和测pH法。a.沉淀法:加入BaCl2溶液或CaCl2溶液,产生沉淀的是Na2CO3溶液。b.气体法:滴入稀盐酸,立即产生气泡的是NaHCO3溶液。c.测pH法:用pH试纸测相同浓度的稀溶液,pH大的是Na2CO3溶液。(2)Na2CO3、NaHCO3的除杂序号混合物(括号内为杂质)除杂方法①Na2CO3(s)(NaHCO3)加热法②NaHCO3(aq)(Na2CO3)通入足量CO2③Na2CO3(aq)(NaHCO3)滴加适量NaOH溶液特别提醒:1.NaHCO3与碱溶液反应的实质是HCO与OH-反应生成CO,CO有可能发生后续反应,如NaHCO3与Ca(OH)2溶液反应可以生成白色沉淀CaCO3;2.不能用澄清石灰水来鉴别Na2CO3与NaHCO3:Ca(OH)2溶液与二者反应均生成白色沉淀CaCO3,无法区别;3.用盐酸鉴别Na2CO3溶液和NaHCO3溶液时,要求两溶液浓度相差不大,且加入的盐酸等浓度且不宜过大;4.Na2CO3、NaHCO3与酸、碱、盐的反应均为复分解反应,因而反应能否进行应从复分解反应的条件来判断。4.Na2CO3、NaHCO3与盐酸反应的基本图象(1)向Na2CO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系如图所示。图象特点:Oa段、ab段消耗盐酸的体积相等。反应原理:Oa段 CO+H+===HCO,ab段 HCO+H+===H2O+CO2↑。(2)向NaHCO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系如图所示。图象特点:从O点开始即产生CO2气体。反应原理:HCO+H+===H2O+CO2↑。(3)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系如图所示(设Na2CO3、NaHCO3的物质的量之比为mn=11,其他比例时的图象略)。图象特点:Oa段消耗HCl的量小于ab段消耗HCl的量。反应原理:Oa段 CO+H+===HCO,ab段 HCO+H+===H2O+CO2↑。(4)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系如图所示(设NaOH、Na2CO3的物质的量之比xy=11,其他比例时的图象略)。图象特点:Oa段消耗HCl的量大于ab段消耗HCl的量。反应原理:Oa段 H++OH-===H2O,CO+H+===HCO;ab段 HCO+H+===H2O+CO2↑。5.主要用途(1)碳酸钠:用于造纸、制造玻璃、制皂、洗涤等。(2)碳酸氢钠:用于制发酵粉、医药、灭火剂等。6.Na2CO3的制备—侯氏制碱法①原料食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气其反应为C+H2O(g)CO+H2,CO+H2O(g)CO2+H2。②工艺流程③反应原理产生NaHCO3反应:NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。产生Na2CO3的反应:2NaHCO3Na2CO3+CO2↑+H2O。④循环使用的物质:CO2。智能点四、碱金属元素、焰色反应1.碱金属的一般性与特殊性(1)一般性 相似性递变性(由Li→Cs)原子结构最外层均为1个电子电子层数逐渐增多核电荷数逐渐增大原子半径逐渐增大元素性质都具有较强的金属性,最高正价均为+1价金属性逐渐增强单质性质物理性质(除Cs外)都呈银白色,密度较小,熔、沸点较低密度逐渐增大(钾反常),熔、沸点逐渐降低化学性质都具有较强的还原性还原性逐渐增强;与O2反应越来越剧烈,产物越来越复杂(2)特殊性①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。2.焰色反应(1)焰色反应的概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,属于物理变化,是元素的性质。(2)焰色反应的操作铂丝无色待测物观察火焰颜色铂丝无色(3)常见元素的焰色钠元素黄色;钾元素紫色(透过蓝色钴玻璃观察);铜元素绿色。特别提醒:1.焰色反应是物理变化,是金属元素的性质,既可以是单质,也可以是化合物,如不论灼烧Na2CO3、NaCl、Na2SO4还是钠的单质,均发出黄色火焰。2.(1)用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物在高温时可挥发。(2)焰色反应中所用的火焰应是无色或浅色的。(3)灼烧铂丝时应一直烧至火焰恢复到原来的颜色。(4)可用洁净的铁丝代替铂丝,不能用铜丝代替。3.碱金属常从以下几个方面设问题(1)碱金属单质与水(或酸)反应的现象;(2)碱金属单质的保存(注意碱金属的密度);(3)碱金属单质与氧气反应产物的判断;(4)碱金属对应的氢氧化物碱性强弱的比较;(5)碱金属的碳酸盐性质的比较;(6)与最新的科学技术相关的碱金属的应用。【典例剖析】高频考点1 考查钠的性质及其应用例1.下列叙述不正确的是( )A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2===Na2O2B.4.6 g Na与O2完全反应,生成7 g产物时失去电子的物质的量为0.2 molC.Na与稀硫酸反应的离子方程式为2Na+2H+===2Na++H2↑D.将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出【变式训练】(2020·浙江绍兴市·高三一模)下列关于钠及其化合物说法,不正确的是A.Na2O2可作漂白剂和呼吸面具中的供氧剂B.高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场照明C.碳酸氢钠是发酵粉的主要成分之一D.金属钠还原性强,可用湿法冶炼法制备稀有金属钛、锆、铌等高频考点2 考查钠的氧化物及其应用例2.(2020·武威第六中学高三月考)下列叙述正确的是( )①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀③钠在常温下不容易被氧化④Na2O2可作供氧剂,而Na2O不行⑤石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3A.都正确 B.②③④⑤ C.④⑤⑥ D.②⑤⑥【变式训练】(2020·河南安阳一中模拟)1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )A.Na2CO3 B.Na2O2、Na2CO3C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3高频考点3 考查碳酸钠和碳酸氢钠的性质及其应用例3.(2021·上海嘉定区·高三二模)有关和的性质,以下叙述错误的是A.等质量的和与足量盐酸反应,在相同条件下产生的体积大B.同物质的量浓度的两种溶液,溶液的大于溶液C.将石灰水加入溶液中不产生沉淀,加入溶液中产生白色沉淀D.等物质的量的两种盐与同浓度盐酸完全反应,所耗盐酸的体积是的两倍【变式训练】(2020·武威第六中学高三月考)下列有关Na2CO3和NaHCO3的叙述中正确的是( )A.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2B.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同C.相同温度下物质的量浓度相同时,Na2CO3溶液的pH小于NaHCO3溶液D.向Na2CO3饱和溶液中通入CO2,有NaHCO3晶体析出高频考点4 考查碱金属的性质及其应用例4.(2020·云南昆明第三中学模拟)下列有关碱金属的叙述正确的是( )A.随核电荷数的增加,碱金属单质的熔点逐渐升高B.碱金属单质的金属性很强,均能与氢气、氮气等直接发生反应C.碳酸铯用酒精灯加热时不能分解为二氧化碳和氧化铯D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水【变式训练】下列关于碱金属的叙述正确的是( )A.碱金属物理性质相似,均为银白色金属B.碱金属单质的金属性很强,均易与氯气、氧气等发生反应C.随核电荷数的增加,碱金属单质的密度逐渐增大D.焰色反应为化学变化高频考点5 考查钠及其化合物的有关计算例5.(2020·广东肇庆市·高三一模)向100 mL某浓度的NaOH溶液中通入一定量后,再向所得溶液中逐滴滴加0.1 mol/L的盐酸,滴加过程中生成气体的体积(标准状况下测得)与滴加盐酸的体积关系如图。下列说法错误的是A.滴加盐酸前的溶液中所含溶质为和B.C.原NaOH溶液浓度为0.2 mol/LD.过程中发生反应的离子方程式为【变式训练】(2020·北京海淀区·清华附中高三三模)在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是A.Na2O和Na2O2 均为碱性氧化物B.参加反应的NaHCO3物质的量为 0.04 molC.反应过程中总共转移 0.04 mol 电子D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L高频考点6 考查钠及其化合物的有关实验例6.(2020·东北育才学校高三零模)钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气,但是它与煤油不会发生反应。把一小块银白色的金属钠投入到盛有蒸镏水的烧杯中,如图a所示,可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧。如果在上述盛有蒸镏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上,如图b所示,同样与水发生剧烈的反应,但不发生燃烧。图a图b(1)在第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和永的界面上,这两个现象说明了:________。(2)在第二个实验中,钠也与水发生反应,但不发生燃烧,这是因为________。(3)我们知道,在金属活动性顺序中,排在前面的金属能把排在后面的金属从它的盐溶液里置换出来,可将金属钠投入到硫酸铜溶液中,却没有铜被置换出来,而产生了蓝色沉淀,请用化学方程式解释这一现象____。【变式训练】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。(1)实验步骤:①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是________。②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是_______________________。④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______________、_______________。⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。(2)关于该实验方案,请回答下列问题。①若加热反应后不鼓入空气,对测定结果的影响是_____。②E处干燥管中盛放的药品是_____,其作用是________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”“偏小”或“无影响”)。③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
相关试卷
这是一份高考化学一轮复习精讲精练第10讲 钠及其重要化合物(精练)(2份打包,解析版+原卷版,可预览),文件包含高考化学一轮复习精讲精练第10讲钠及其重要化合物精练解析版doc、高考化学一轮复习精讲精练第10讲钠及其重要化合物精练原卷版doc等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份高考化学一轮复习精讲精练第11讲 铁及其重要化合物(精讲)(2份打包,解析版+原卷版,可预览),文件包含高考化学一轮复习精讲精练第11讲铁及其重要化合物精讲解析版doc、高考化学一轮复习精讲精练第11讲铁及其重要化合物精讲原卷版doc等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
这是一份高考化学一轮复习精讲精练第10讲 钠及其重要化合物(精讲)(2份打包,解析版+原卷版,可预览),文件包含高考化学一轮复习精讲精练第10讲钠及其重要化合物精讲解析版doc、高考化学一轮复习精讲精练第10讲钠及其重要化合物精讲原卷版doc等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。








