






化学第二节 水的电离和溶液的pH说课课件ppt
展开第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的PH
第2课时 酸碱中和滴定
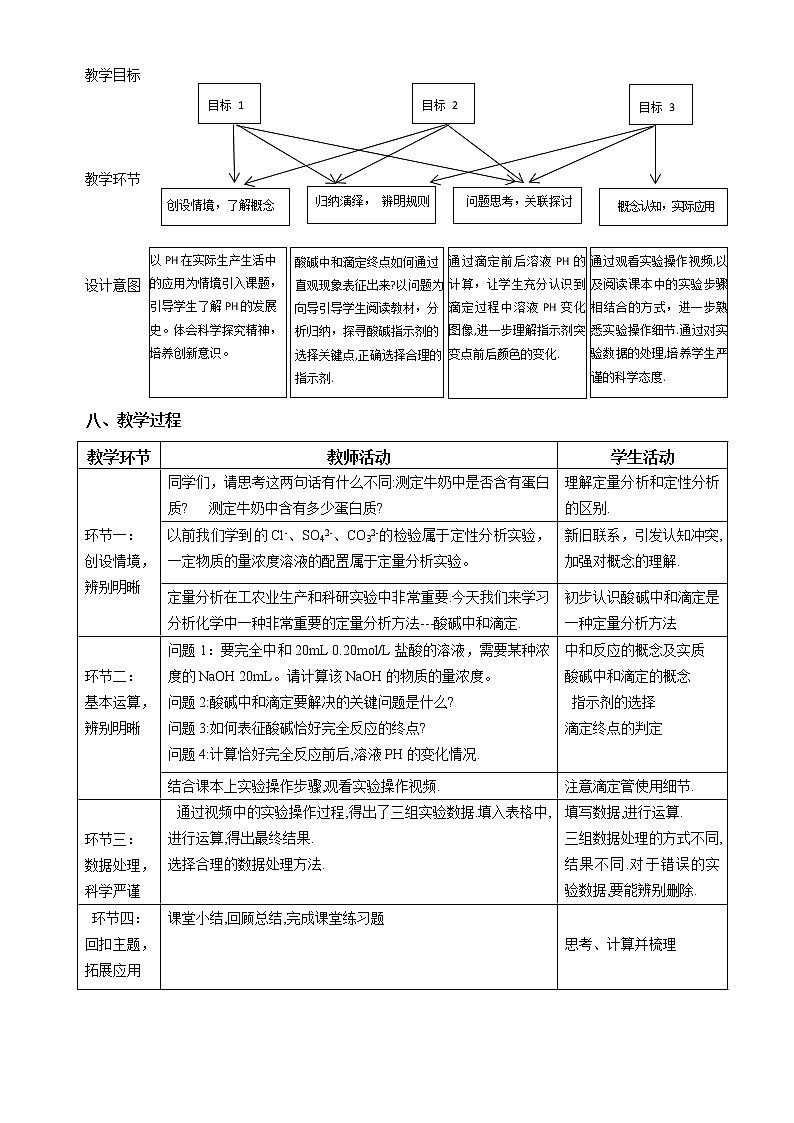
【学习目标】
1. 理解酸碱中和滴定原理,了解酸碱中和滴定的基本操作。
2. 能进行酸碱中和滴定的相关计算。
3. 通过中和滴定实验数据的处理和计算,培养实事求是的科学态度。
【学习过程】
知识回顾:
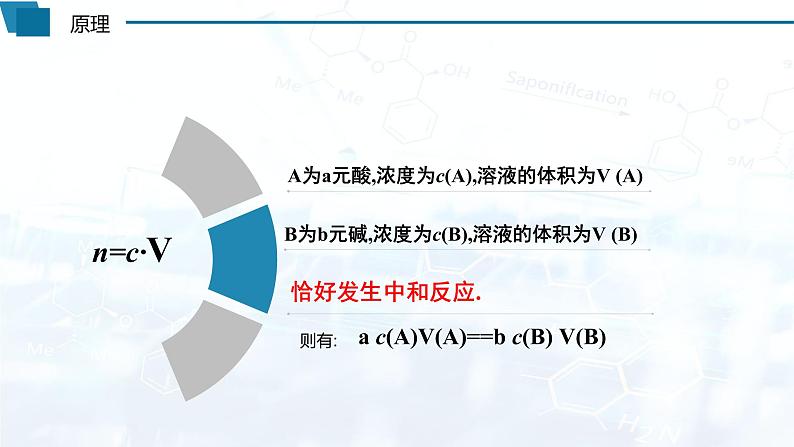
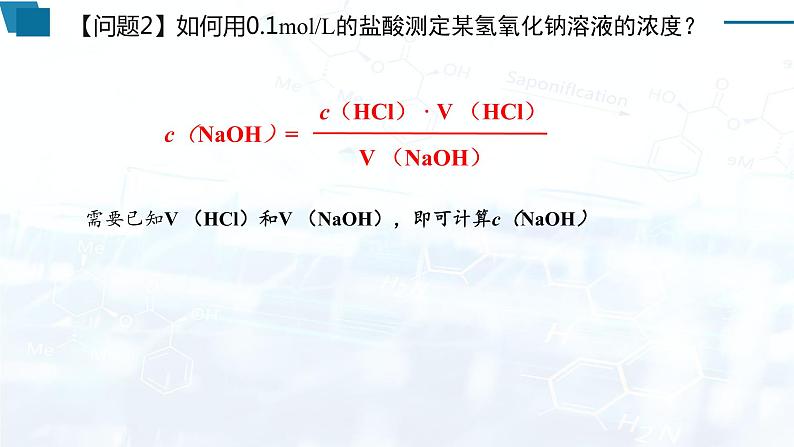
问题1:要完全中和20mL 0.20mol/L盐酸的溶液,需要某种浓度的NaOH 20mL。请计算该NaOH的物质的量浓度。
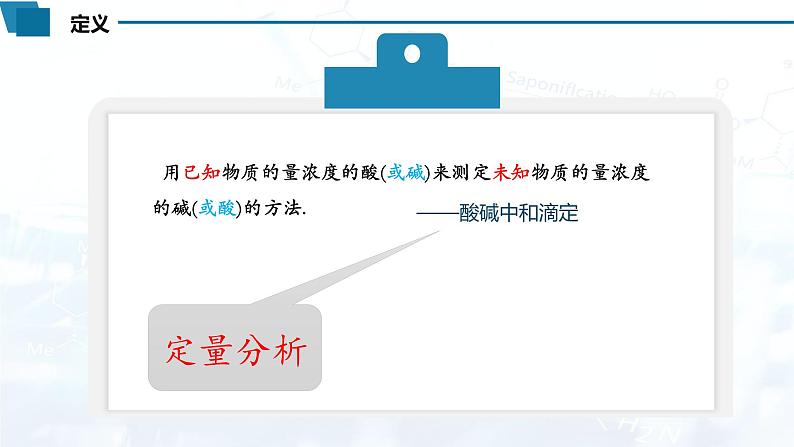
酸碱中和滴定的定义: .
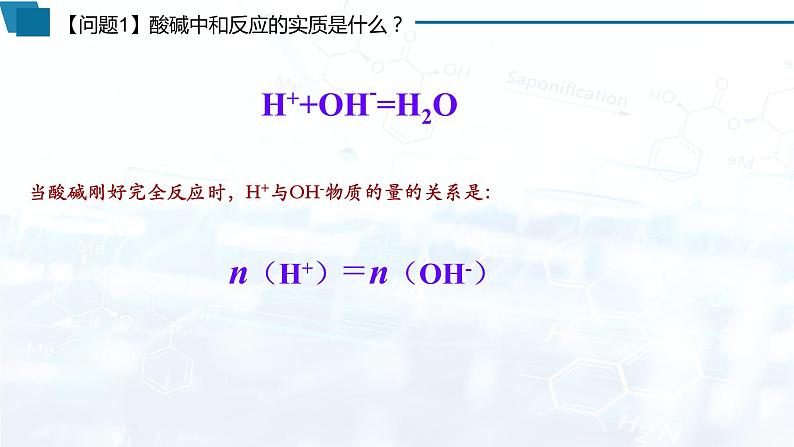
一、酸碱中和滴定原理
实质:
问题2:酸碱中和滴定要解决的关键问题是什么?
二、酸碱中和滴定
1、仪器: 、碱式滴定管、 、铁架台、滴定管夹
2、药品:已知浓度的盐酸标准液、NaOH未知溶液、酚酞
问题3:如何表征酸碱恰好完全反应的终点?
问题4:计算恰好完全反应前后,溶液PH的变化情况.(以0.20mol/L盐酸溶液滴定20mL 0.20mol/LNaOH溶液为例,假设半滴溶液的体积为0.02 mL)
(1) 当盐酸溶液的体积为19.98mL时,溶液PH为:
(2) 当盐酸溶液的体积为20.00mL时,溶液PH为:
(3) 当盐酸溶液的体积为20.02mL时,溶液PH为:
盐酸溶液的体积/mL | 19.98(少半滴) | 20.00(恰好反应) | 20.02(多半滴) |
溶液PH |
|
|
|
作出图像:
溶液PH
盐酸溶液的体积
3、滴定操作步骤:
准备阶段:检漏→水洗→ →装液(排气泡)→ →取待测液
滴定阶段:滴加指示剂( )→滴加标准液至颜色发生明显变化→记录末读数
操作注意事项:左手 右手 眼睛
4、计算(数据处理)
次数 | 待测NaOH溶液体积VB/mL | 标准盐酸溶液体积VA/mL | ||||
滴定前刻度 | 滴定后刻度 | VB/mL | 滴定前刻度 | 滴定后刻度 | VA/mL | |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
VA的平均值: , 待测NaOH溶液的浓度:
【学习效果】
1.读出以下液体体积的读数
读数:
读数:
滴定管
2.有一支50mL的滴定管,其中盛有溶液,液面恰好在10mL刻度处,把滴定管中的液体全部流下排除,承接在量筒中,量筒中的溶液的体积( )
A.大于40.0mL B.等于40.0mL C.小于40.0mL D.等于10.0mL
3.下列有关中和滴定的实验操作正确的是
A.滴定管用蒸馏水洗涤后,加入待装液
B.移液管用蒸馏水洗涤后,加入待装液
C.滴定接近终点时,滴定管的尖嘴接触了锥形瓶内壁
D.滴定到锥形瓶内液体颜色发生变化,马上停止滴定
4.用0.01 mol·L-1H2SO4滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设一滴为0.05mL)。则①和②中C(H+)之比是( )。
A .10 B.50 C.5×103 D.104
5.某未知溶液可能由NaOH、Na2CO3、NaHCO3中的一种或两种物质组成。现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度盐酸进行滴定。当达到滴定终点,消耗盐酸的体积分别为V1mL和V2mL。如V1<V2<2V1 ,则上述溶液中溶质是( )
A.NaHCO3 B.Na2CO3
C. NaHCO3 、Na2CO3 D.NaOH、Na2CO3
【学习总结】:
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性试讲课课件ppt: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性试讲课课件ppt,共31页。PPT课件主要包含了课前导入,滴定管,小专题,滴定实验中的误差分析,误差分析的方法,作业布置,预习盐类水解等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 水的电离和溶液的pH精品ppt课件: 这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH精品ppt课件,共29页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
2020-2021学年第二节 水的电离和溶液的pH授课ppt课件: 这是一份2020-2021学年第二节 水的电离和溶液的pH授课ppt课件,文件包含人教版高中化学选择性必修1第3章第2节能力课时4酸碱中和滴定的拓展应用课件ppt、人教版高中化学选择性必修1第3章第2节能力课时4酸碱中和滴定的拓展应用学案doc等2份课件配套教学资源,其中PPT共54页, 欢迎下载使用。













