





人教版 (2019)必修 第一册第二节 金属材料课文课件ppt
展开合金是两种或两种以上的金属(或金属跟非金属) 熔合而成的具有金属特性的物质。
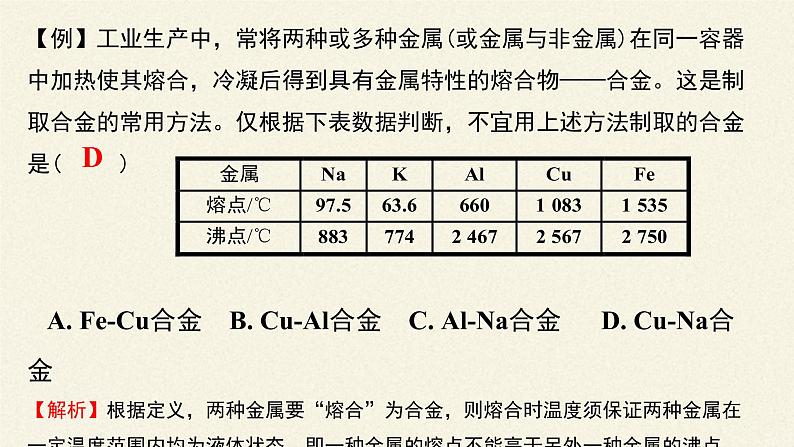
【例】工业生产中,常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法。仅根据下表数据判断,不宜用上述方法制取的合金是( ) A. Fe-Cu合金 B. Cu-Al合金 C. Al-Na合金 D. Cu-Na合金【解析】根据定义,两种金属要“熔合”为合金,则熔合时温度须保证两种金属在一定温度范围内均为液体状态,即一种金属的熔点不能高于另外一种金属的沸点。
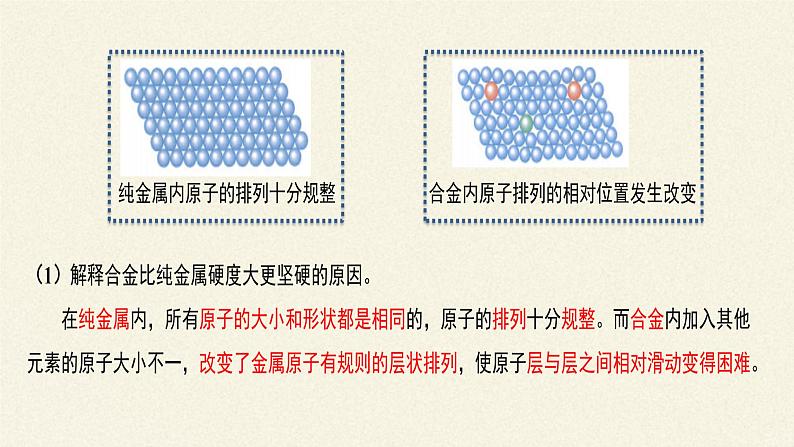
合金具有许多良好的物理、化学或机械性能,如合金的硬度、熔点不同于其成分金属,可以满足不同需要。合金的熔点比它的各成分金属的熔点都低;硬度比单一金属大;化学性质与单一成分不同;机械性能常优于单一成分。
合金是混合物,但其组成是均匀的。而且有些合金具有固定熔点。在商朝(距今3000多年前)青铜(铜-锡合金)工艺就已非常发达。
认识合金的常见误区 (1)误认为合金都是由金属构成的。事实上,凡是在金属中加热熔合某些金属或非金属而得到的具有金属特性的物质都是合金; (2)以为金属材料都是由金属单质制成的。实际上,很多金属材料都是合金,合金具有较纯金属更广阔的应用范围。 (3)合金不一定是固态,如用作原子反应堆导热剂的钠—钾合金,常温下为液态。
合金钢:(特种钢)在碳素钢里适当地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀性等。 如不锈钢(熔合的金属为铬Cr和镍Ni)
铝是地壳中含量最多的金属元素。
铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面生成一层致密的氧化铝薄膜。
Al2O3和MgO致密,熔点高,做耐火材料
【思考】铁在空气中被氧化表面生成氧化铁而生锈腐蚀,而生锈后内部的铁被腐蚀的程度和速度都会越来越严重,那么,铝呢?
1. Al、Al2O3和盐酸反应
现象∶铝片表面有大量气泡产生,试管壁有发热现象。一段时间后,将点燃的木条放在试管口可观察到淡蓝色火焰。
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
Al2O3 + 6HCl === 2AlCl3 + 3H2O
2Al + 6HCl === 2AlCl3 + 3H2↑
结论∶铝表面的保护膜和铝均能与盐酸发生反应。
2. Al、Al2O3和NaOH溶液反应
【实验3-5】在两支试管中分别加入少量NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口,你观察到什么现象?
开始没有气泡,一段时间后产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
立即产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。例如Al2O3。
氢能是人类未来的理想能源之一,氢能利用存在两大难题。
H2是一种易燃易爆的气体,要利用H2,关键要解决H2的安全储存和运输问题。
一般情况下,H2采用气态和液态储存,如在更高压下把H2压入钢瓶,但运送笨重的钢瓶既不方便也不安全。储氢合金的发现很好的解决了这个问题。
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。具有使用价值的储氢合金要求储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、放氢的速率快。如Ti-Fe合金和La-Ni合金等。
近年来,为了满足某些尖端技术发展的需要,人们设计和合成了许多新型合金。 新型储氢合金材料的研究和开发为氢气作为能源的实际应用起到重要的推动作用。 钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
可用于制作我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造的。
可用于制作喷气式飞机的发动机叶片。
由镍、铁、碳、钴组成的镍钴合金用于制造发动机叶片,它能承受1100℃的高温。
8. 下列反应的离子方程式书写正确的是( )A.钠和冷水反应:Na+2H2O==Na++2OH-+H2↑B.金属铝溶于NaOH溶液:Al+2OH-==AlO-+H2↑C.金属铝溶于盐酸中:2Al+6H+==2Al3++3H2↑D.铁与稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
白色胶状固体,能凝聚水中的悬浮物,并能吸附色素
②胃酸中和剂:能与酸反应且碱性不强
①净水剂:能吸附水中的悬浮物
Al3++3NH3•H2O==Al(OH)3↓+3NH4+
实验室里常用铝盐溶液与氨水反应来制取氢氧化铝
Al(OH)3+NaOH=NaAlO2+2H2O
结论:Al(OH)3能溶于酸和强碱溶液,是一种两性氢氧化物
Al(OH)3 + 3HCl = AlCl3 + 3H2O
②与NaOH溶液反应:
③不稳定性:受热易分解
物质由原子、分子、离子等粒子构成,物质之间的化学反应也是这些粒子按一定数目关系进行的。化学方程式中的化学计量数可以明确表示出化学反应中粒子之间的数目关系。例如:
化学计量数之比扩大6.02×1023倍物质的量之比
从上例中化学反应中粒子之间的数目关系可以看出什么?
化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
250mL 2ml/L的硫酸与足量的铁屑完全反应。计算:(1)参加反应的铁屑的物质的量(2)生成H2的体积(标准状况)
(1)参加反应的铁屑的物质的量
(2)生成H2的体积(标准状况)
练习:向500ml的氢氧化钠溶液中投入10.8g的铝,恰好完全反应,计算:(1)氢氧化钠溶液的物质的量浓度;(2)生成的氢气在标准状况下的体积。
7. 足量铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为( )A.1︰2 B.3︰2 C.3︰1 D.6︰1
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料获奖ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料获奖ppt课件,共14页。PPT课件主要包含了学习目标,情境导入,学习任务,学习活动,任务一认识金属材料,任务二铁合金的使用,练习与测评等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 金属材料完整版课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料完整版课件ppt,共17页。PPT课件主要包含了学习目标,情境导入,铝合金,学习任务,学习活动,认识铝合金的应用,认识新型合金的应用,练习与测评等内容,欢迎下载使用。
高中化学第二节 金属材料课堂教学课件ppt: 这是一份高中化学第二节 金属材料课堂教学课件ppt,共24页。PPT课件主要包含了导热性,延展性,导电性,金属特性,金属分类,纯金属材料,结构决定性质,铁合金,练一练,铜合金等内容,欢迎下载使用。













