

山东省烟台市2023届高三上学期期中学业水平诊断化学试卷
展开高三化学
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 K 39 Cu 64 Ba 137
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学使科技进步,使生活更美好。下列说法错误的是( )
A.火箭箭体采用的高强度新型钛合金结构属于金属材料
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
C.北京冬奥会采用的“绿电”来自光伏发电,太阳能电池的主要成分为Si
D.“天问一号”火星车的热控保温材料——纳米气凝胶,具有丁达尔效应
2.下列实验操作错误的是( )
A.水银洒在地上,撒上硫粉并进行处理 B.常温下,用铝或铁制容器盛装浓硝酸、浓硫酸
C.碳酸钠溶液应保存在带有玻璃塞的试剂瓶中 D.实验剩余的金属钠应放回原试剂瓶中
3.设为阿伏加德罗常数的值。下列说法正确的是( )
A.25g质量分数为46%的乙醇水溶液中含有的氢原子数为
B.2molNO与1mol在密闭容器中充分反应后的分子数为
C.电解精炼铜过程中当电路中通过电子时,阳极有16gCu转化为
D.的溶液显中性,1L该溶液中含数为
4.类比法是化学上研究物质的重要方法之一,下列类比结果合理的是( )
A.Fe和S反应生成FeS,则Cu和S反应生成
B.工业上电解熔融的冶炼镁,则电解熔融的可以冶炼铝
C.通入溶液中没有现象,则通入溶液中也无明显现象
D.镁、铝、稀组成的原电池中镁作负极,则镁、铝、NaOH溶液组成的原电池中镁也作负极
5.如图是一种可实现氢气循环的新型电池放电工作原理。下列说法正确的是( )
A.放电时,N电极作正极
B.充电过程中由右池通过交换膜向左池移动
C.放电时,N极电极反应式为
D.充电时,M极与电源正极相连
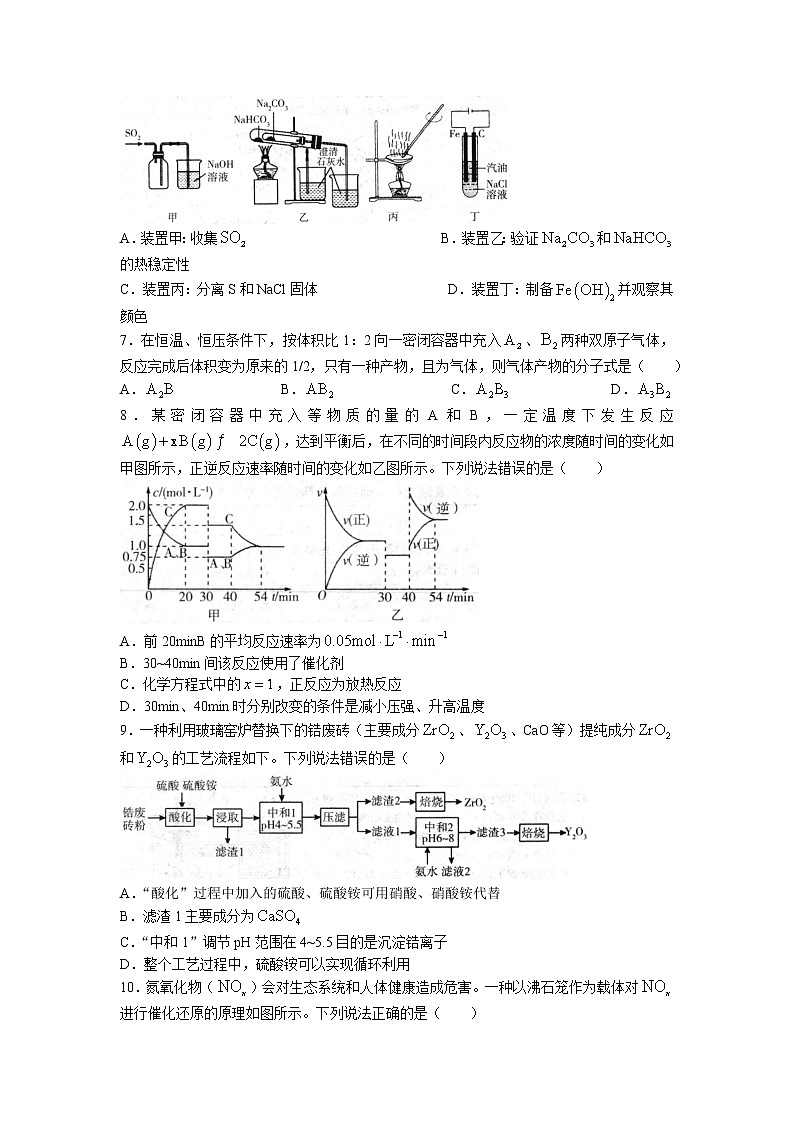
6.下列实验装置能达到实验目的的是( )
A.装置甲:收集 B.装置乙:验证和的热稳定性
C.装置丙:分离S和NaCl固体 D.装置丁:制备并观察其颜色
7.在恒温、恒压条件下,按体积比1:2向一密闭容器中充入、两种双原子气体,反应完成后体积变为原来的1/2,只有一种产物,且为气体,则气体产物的分子式是( )
A. B. C. D.
8.某密闭容器中充入等物质的量的A和B,一定温度下发生反应,达到平衡后,在不同的时间段内反应物的浓度随时间的变化如甲图所示,正逆反应速率随时间的变化如乙图所示。下列说法错误的是( )
A.前20minB的平均反应速率为
B.30~40min间该反应使用了催化剂
C.化学方程式中的,正反应为放热反应
D.30min、40min时分别改变的条件是减小压强、升高温度
9.一种利用玻璃窑炉替换下的锆废砖(主要成分、、CaO等)提纯成分和的工艺流程如下。下列说法错误的是( )
A.“酸化”过程中加入的硫酸、硫酸铵可用硝酸、硝酸铵代替
B.滤渣1主要成分为
C.“中和1”调节pH范围在4~5.5目的是沉淀锆离子
D.整个工艺过程中,硫酸铵可以实现循环利用
10.氮氧化物()会对生态系统和人体健康造成危害。一种以沸石笼作为载体对进行催化还原的原理如图所示。下列说法正确的是( )
A.反应①中消耗1mol,转移4mol
B.含Cu化合物参与的反应一定有电子转移
C.反应⑤中氧化剂与还原剂的物质的量之比为1:1
D.图中总变化过程可表示为
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验现象以及结论都正确且两者具有因果关系的是( )
| 实验操作 | 现象 | 结论 |
A | 将过量铁粉加入到稀硝酸中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | Fe被氧化为 |
B | 将氨水滴加到红色石蕊试纸上 | 试纸变蓝 | 氨气是显碱性的电解质 |
C | 将浓硫酸与蔗糖混合搅拌,并用湿润的品红试纸检验产生的气体 | 蔗糖变黑,品红试纸褪色 | 浓硫酸具有脱水性和氧化性 |
D | 常温下,取相同物质的量浓度的两种溶液:①、②,分别测其pH | 测得pH:①>② | 的水解程度:①>② |
12.我国力争2060年前实现碳中和,如图利用电解法吸收制得HCOOK,下列说法错误的是( )
A.Sn片上发生的电极反应为
B.相同状况下,气体a、b的体积之比为1:2
C.电解一段时间后,左侧溶液的浓度降低
D.电路中转移0.04mol时左侧溶液的质量减少1.88g
13.氧化钪()广泛用于航天、激光和导弹等尖端科学领域。一种从钛白酸性废水(含、、、、)中富集钪并制备的工艺流程如下。可能用到的数据见下表。
金属离子 | ||||
开始沉淀pH | 1.3 | 6.8 | 1.9 | 4.0 |
沉淀完全pH | 2.3 | 9.0 | 3.2 | 5.0 |
已知:“有机相”中主要含有、、。下列说法正确的是( )
A.加的目的是将氧化为
B.操作Ⅰ用到的玻璃仪器有玻璃棒、烧杯和分液漏斗
C.加10%盐酸调pH的范围为3.2~4.0
D.草酸钪焙烧生成是非氧化还原反应
14.催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应①:
反应②:
在0.5MPa条件下,将为1:3的混合气体以一定流速通过装有催化剂的反应器,实验测得的转化率、的选择性与温度的关系如图所示。下列说法错误的是( )
A.升高温度时,CO的选择性增大
B.一定温度下,增大起始的比值,可提高的平衡转化率
C.其他条件不变,在280~400℃,产物中随温度的升高先增大后减小
D.一定温度下,选用高效催化剂可提高的平衡产率
15.25℃时,用HCl气体调节氨水的pH,溶液中微粒浓度的对数值()、反应物的物质的量之比与pH的关系如下图。若忽略通入气体后溶液体积的变化,下列说法错误的是( )
A.所示溶液中:
B.所示溶液中:
C.所示溶液中:
D.25℃时,的电离平衡常数为
三、非选择题:本题共5小题,共60分。
16.(12分)某实验小组以BaS溶液为原料制备,并用重量法测定产品中的含量。设计了如下实验方案:
可选用试剂:NaCl晶体、BaS溶液、溶液、溶液、浓硫酸、蒸馏水
步骤1.的制备
按图1所示装置进行实验,得到溶液,经蒸发浓缩、冷却结晶、过滤等步骤获得产品。
步骤2.产品中的含量测定
①称取产品0.5000g,用水溶解,配成25mL溶液;
②用标准溶液滴定①所得溶液,测得溶液电导率及随滴入标准溶液的体积的变化关系如图2所示。
回答下列问题:
(1)固体BaS在潮湿空气中长期放置,会逸出臭鸡蛋气味的气体,且水溶性变差(其原因是表面生成了难溶于水的白色固体)。写出该过程的化学方程式______。
(2)装置Ⅰ为气体发生装置,该装置所选用的试剂为______。
(3)上述实验装置中存在安全隐患,改进措施是______;Ⅲ中反应的离子方程式为______。
(4)______,若不考虑溶液混合引起的体积变化,则时溶液中______。
(5)产品中的质量分数为______。
17.(12分)以钛白渣(主要成分为,含有少量及)为原料,生产氧化铁黄(α-FeOOH)的工艺流程如下:
已知:常温下;
(1)“溶解”时,发生水解生成难溶于水的,反应的化学方程式为______;“除杂”时,加入过量铁粉的作用除了防止被氧化外还有______。
(2)常温下,实验测定滤液①的,,则滤液①中______。
(3)实验室用如图1所示装置(部分夹持装置省略)模拟制备FeOOH的过程操作如下:
ⅰ.______;
ⅱ.关闭止水夹,一段时间后,打开;
ⅲ.当乙中时,关闭、,打开,通入空气。溶液中的pH随时间变化如图2所示。
①将操作i补充完整:______。
②pH≈4时制得FeOOH(如图2所示)。0-时段,pH几乎不变;-时段,pH明显降低。结合方程式解释原因:______。
(4)合格氧化铁黄的色光度值范围为―0.5~0.5,氧化过程中溶液的pH对产率、色光度的影响如图所示,氧化时应控制pH的合理范围是______,pH过大会导致产品的颜色变黑,可能含有的杂质______(填化学式)。
18.(12分)全球大气浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的溶于水存在以下过程:
①
②
过程①的混合平衡常数,其中表示溶液中的浓度,表示大气中的分压(单位:kPa)。温度升高,______(填“增大”或“减小”);当大气压强为akPa,溶液中的(忽略和水的电离)时,大气中的体积分数为______。
(2)由转化制甲醇具有重要的经济效益。反应,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
该反应历程中决速步骤的化学方程式为______,有催化剂时决速步骤的活化能为______eV。
(3)一种脱除和利用工厂废气中方法的示意图如下:
①某温度下,吸收塔中溶液吸收一定量的后,溶液的,则=______(该温度下的,);
②再生塔中产生的离子方程式为______。
③利用电化学原理将同时转化为多种燃料(、、及CO),将电催化还原为,阴极反应式为则正极区产生气体标准状况下的体积为______。若铂电极上只生成6.4g,则正极区产生气体标准状况下的体积为______L。
19.(12分)二氧化氯是一种高效消毒灭菌剂,但其稳定性较差,故常采用和NaOH混合溶液将其吸收转化为保存。现利用如下装置及试剂制备。
已知:
(1)纯的或浓度较大的易分解爆炸;极易溶于水,与碱性条件下会剧烈反应并放出大量的热。
(2)饱和溶液在温度低于38℃时析出的晶体是,高于38℃时析出的晶体是,高于60℃时分解成和NaCl。
回答下列问题:
(1)装置A中a的作用是______;仪器b的名称为______。
(2)装置A中发生反应的化学方程式为______,上述装置存在一处缺陷,会导致产率降低,改进的方法是______。
(3)实验过程中持续通入的速度不能太慢也不能太快的原因是______。
(4)从溶液中获得固体的操作:
①减压,55℃蒸发结晶;②______;③无水乙醇洗涤;④______,得到成品。
(5)纯度的测定:用“间接碘量法”测定样品(杂质与不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀,再滴加几滴淀粉溶液(已知:),然后用标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为(已知:)。样品中的纯度为______%(用含c、V的代数式表示)。下列滴定操作会导致测量结果偏低的是______(填字母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c.滴定终点时仰视读数 d.滴定管滴定前没有气泡,滴定后尖嘴处出现气泡
20.(12分)煤的气化是一种重要的制氢途径。回答下列问题:
在一定温度下,向体积可变的恒压密闭容器中加入1mol和1mol,起始体积为1L时,发生下列反应生成水煤气:
Ⅰ.
Ⅱ.
(1)下列说法错误的是______。
A.降低反应温度,反应Ⅰ、Ⅱ的正、逆反应速率都减小
B.混合气体的质量保持不变时,说明反应体系已达到平衡
C.平衡时的分压可能是的2倍
D.平衡时向容器中充入惰性气体,反应Ⅱ的平衡一定不移动
(2)反应平衡时,与分压相同,容器体积为1.3L。此时,整个体系______(填“吸收”或“放出”)热量______kJ,的平衡转化率为______,反应Ⅱ的平衡常数______。
(3)设为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)。除以。反应Ⅰ、Ⅱ的随(温度的倒数)的变化如图所示。
①表示反应Ⅰ对应的曲线是______(填序号)。
②在图中A点对应温度下、原料组成为、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时的转化率为50%。该温度下反应Ⅰ的为______,的平衡分压为______。
2022-2023学年度第一学期期中学业水平测试
高三化学参考答案
1.B 2.C 3.A 4.A 5.D 6.D 7.C 8.B 9.A 10.D
11.C 12.BD 13. AC 14.D 15.AD
16.(12分)
(1) BaS+H2O+CO2=BaCO3+H2S(2分)
(2)NaCl晶体和浓硫酸(2分)
(3)在装置Ⅰ和Ⅱ之间加一个防倒吸的装置(2分) Cu2++H2S=CuS↓+2H+(1分)
(4)1×10-10(1分) 3.25×10-9 mol∙L-1(2分)
(5)97.6%(2分)
17.(12分)
(1)TiOSO4+(x+1)H2O=TiO2·xH2O↓+H2SO4 (2分)
与H+反应,使得TiO2++2H2O TiO2·H2O↓+ 2H+平衡正向移动,有利于沉钛(2分)
(2)1mol∙L-1(2分)
(3)①关闭K2,打开止水夹与K1 (2分)
②pH=6.0左右,4Fe(OH)2 +O2+ 2H2O= 4Fe(OH)3因此pH几乎不变;之后发生4Fe2+ + O2+ 6H2O= 4FeOOH + 8H+, 溶液中H+浓度增大,pH减小(2分)
(4)3.5~4.0(1分) Fe3O4(1分)
18.(12分)(1) 减小(1分) (2分)
(2)H2COO*+2H2(g)=H2CO*+OH*+ H2(g)或H2COO*+ H2(g)=H2CO*+OH*(1分) 1.4(1分)
(3) ①20(2分) ②2HCO3-CO2↑+CO32-+H2O(1分)
③2CO2 +10e- +10H+=CH3CHO+ 3H2O(2分) 17.92(2分)
19.(12分)
(1)平衡气压,有利于液体的顺利滴下(1分) 三颈烧瓶(1分)
(2)Na2SO3+2NaClO3+3H2SO4=2ClO2↑+4NaHSO4+H2O
或Na2SO3+2NaClO3+H2SO4=2ClO2↑+2Na2SO4+H2O(2分)
用冰水浴浸泡装置B(1分)
(3)通入过慢,ClO2浓度偏高,易分解爆炸,通入过快,影响ClO2的吸收转化(2分)
(4)趁热过滤(1分) 于38°C ~60°C干燥(1分)
(5)12.5cV(2分) bd(1分)
20.(12分)(1)CD(2分)
(2)吸收(1分) 31.2(2分) 30% (1分) 2(1分)
(3)①a(1分) ②0.167(2分) 16.67kPa(2分)
山东省烟台市2023-2024学年高二上学期1月期末学业水平诊断化学试题: 这是一份山东省烟台市2023-2024学年高二上学期1月期末学业水平诊断化学试题,共10页。
2024烟台高三上学期期中学业水平诊断化学PDF版含答案: 这是一份2024烟台高三上学期期中学业水平诊断化学PDF版含答案,文件包含山东省烟台市2023-2024学年高三上学期期中学业水平诊断化学pdf、山东省烟台市2023-2024学年高三上学期期中学业水平诊断化学答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
山东省烟台市2022-2023学年高三上学期期末学业水平诊断 化学 Word版含答案: 这是一份山东省烟台市2022-2023学年高三上学期期末学业水平诊断 化学 Word版含答案,文件包含山东省烟台市2022-2023学年高三上学期期末学业水平诊断化学试题docx、山东省烟台市2022-2023学年高三上学期期末学业水平诊断化学答案pdf等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。












