



2022长沙长沙县、望城区、浏阳高一上学期期末考试化学含解析
展开2021年下学期期末调研考试试卷
高一化学
友情提示:
1.本试卷分试题和答题卡两部分,共8页。满分100分,时量75分钟。
2.答案一律在答题卡上书写,在试题卷上作答无效。
3.可能用到的相对原子质量:C-12 Na-23 S-32 O-16 Cu-64 Fe-56 H-1
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 体操运动员比赛前为了防滑,常在手掌上涂抹白色的粉末——碳酸镁,以下有关碳酸镁的说法中正确的是
A. 属于盐 B. 属于氧化物
C. 属于碱 D. 属于碳的同素异形体
【答案】A
【解析】
【详解】A.碳酸镁由镁离子和碳酸根离子组成,故其属于盐,故A正确;
B.碳酸镁含三种元素,不是氧化物,故B不正确;
C.碳酸镁的组成中无OH-,不属于碱,故C不正确;
D.碳酸镁为化合物,且其组成元素中不含碳,故其一定不是碳的同素异形体,D不正确;
故选:A。
2. 下列化学用语正确的是
A. N的原子结构示意图: B. 的电子式:
C. 的结构式: D. 的电子式:
【答案】B
【解析】
【详解】A.N为7号元素,N的原子结构示意图,故A错误;
B.氯化钠是离子化合物,由钠离子与氯离子构成,氯化钠的电子式为 ,故B正确;
C.二氧化碳是共价化合物,中心C原子与O原子之间以双键结合,其结构式为O=C=O,故C错误;
D.HCl为共价化合物,H和F原子间为共价键,正确电子式为: ,故D错误;
故选:B。
3. 下列反应离子方程式正确的是
A. 向石灰石上滴加盐酸:
B. 金属钠和水反应:
C. 硫酸铜溶液和氢氧化钡溶液混合:
D. 通入水中:
【答案】A
【解析】
【详解】A.向石灰石上滴加盐酸反应为:,A符合要求;
B.金属钠和水反应:,B不符合要求;
C.硫酸铜溶液和氢氧化钡溶液混合离子反应为:,C不符合要求;
D.通入水中生成HClO不能拆,反应应为,D不符合要求;
答案为A。
4. 宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”的原理,下列说法正确的是
A. X的化学式为AgS B. 反应中是还原产物
C. 银针验毒时,空气中氧气失去电子 D. 反应中Ag和均是还原剂
【答案】B
【解析】
【详解】A.反应中,根据原子守恒可知,X为Ag2S,A错误;
B.上述反应中,氧气中的O元素化合价从0价降低到-2价,被还原,所以还原产物为,B正确;
C.根据反应原理和化学方程式可知,氧气中的O元素化合价从0价降低到-2价,得电子,被还原,C错误;
D.Ag元素从0价升高到+1价,被氧化,做还原剂,但中各元素化合价并未发生变化,D错误;
故选B。
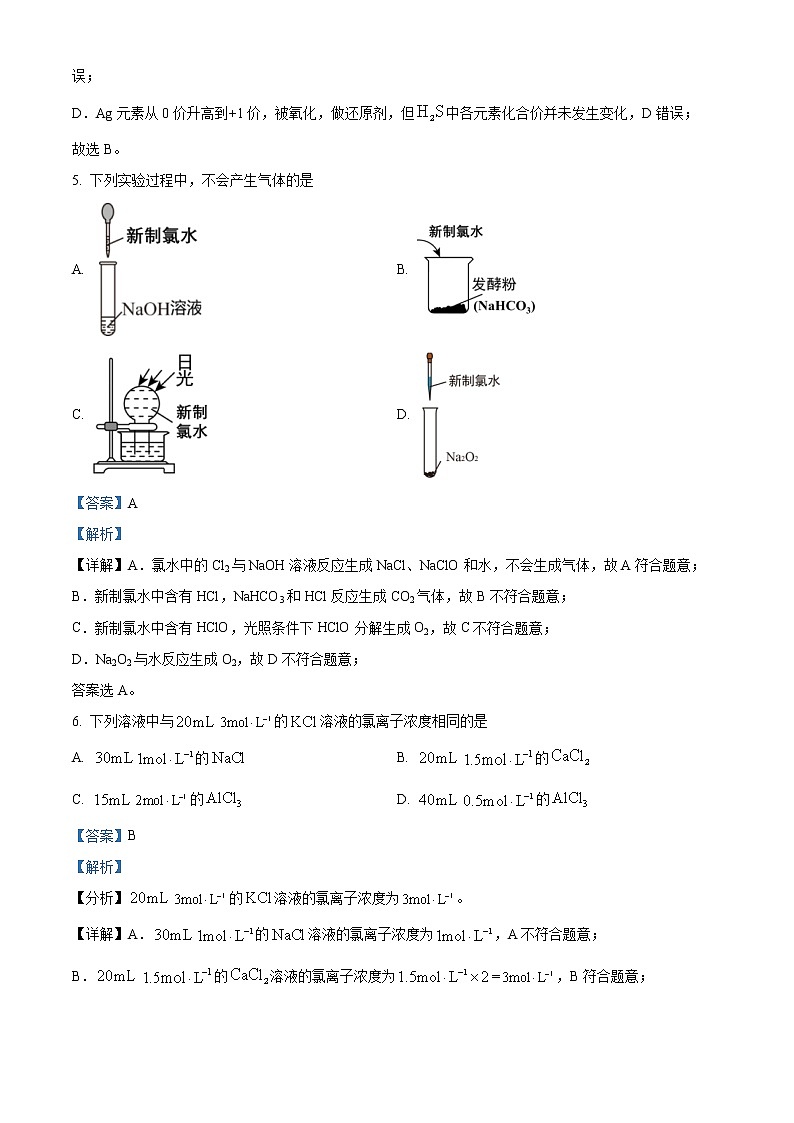
5. 下列实验过程中,不会产生气体的是
A. B.
C. D.
【答案】A
【解析】
【详解】A.氯水中的Cl2与NaOH溶液反应生成NaCl、NaClO和水,不会生成气体,故A符合题意;
B.新制氯水中含有HCl,NaHCO3和HCl反应生成CO2气体,故B不符合题意;
C.新制氯水中含有HClO,光照条件下HClO分解生成O2,故C不符合题意;
D.Na2O2与水反应生成O2,故D不符合题意;
答案选A。
6. 下列溶液中与的溶液的氯离子浓度相同的是
A. 的 B. 的
C. 的 D. 的
【答案】B
【解析】
【分析】的溶液的氯离子浓度为。
【详解】A.的溶液的氯离子浓度为,A不符合题意;
B.的溶液的氯离子浓度为=,B符合题意;
C.的溶液的氯离子浓度为=,C不符合题意;
D.的溶液的氯离子浓度为=,D不符合题意;
故答案选B。
7. 设为阿伏加德罗常数的值.下列说法正确的是
A. 甲烷()所含的电子数为
B. 溶液中含有个
C. 和混合气体中所含有原子数为
D. 与足量充分反应转移的电子数目为
【答案】C
【解析】
【详解】A.未描述标准状况,气体体积不能按22.4L/mol换算为物质的量,描述错误,不符题意;
B.未给出溶液体积,无法计算离子物质的量,描述错误,不符题意;
C.N2和CO的摩尔质量均是28g/mol,故混合气中无论气体成分怎样混合,14g气体的物质的量始终是0.5mol,即气体分子个数为0.5NA,两种气体又都是双原子分子,所以总的原子个数是NA,描述正确,符合题意;
D.1molNa2O2全做氧化剂,氧原子化合价均由-1价降为-2价,总得电子为2mol,即2NA,而Na2O2与CO2反应时Na2O2一部分做氧化剂,一部分做还原剂,氧化剂物质量不足1mol,所以转移电子数不够2NA,描述错误,不符题意;
综上,本题选C。
8. 下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应
②Fe与过量稀H2SO4反应后,再向其中加入KMnO4溶液
③Fe和Fe2O3的混合物溶于盐酸中
A. ① B. ①③ C. ①② D. 全部
【答案】C
【解析】
【详解】①Fe与Cl2反应只生成FeCl3,与Fe的量无关,符合题意;②Fe与过量稀H2SO4反应后生成FeSO4,再向其中加入KMnO4溶液,Fe2+被氧化为Fe3+,符合题意;③Fe和Fe2O3的混合物溶于盐酸中,反应有:Fe+2HCl=FeCl2+H2、Fe2O3+6HCl=2FeCl3+3H2O,Fe+2FeCl3=3FeCl2,故不一定有Fe3+生成,不合题意;综上分析可知,①②符合题意,故答案为:C。
9. 下列说法不正确的是
A. 钢的含碳量为 B. 常温下铝不与氧气反应
C. 氧化铁俗称铁红,常用作油漆、涂料 D. 氧化铝是两性氧化物
【答案】B
【解析】
【详解】A.钢为铁、碳合金,含碳量为0.03%~2%,故A正确;
B.铝性质活泼,常温下与氧气反应生成致密氧化膜,阻止反应继续进行,故B错误;
C.氧化铁俗称铁红,常用作油漆、涂料,故C正确;
D.氧化铝与酸、碱都能反应,且生成物为盐和水,所以属于两性氧化物,故D正确;
故选B。
10. 、和三种核素互为
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
【答案】A
【解析】
【详解】核素是指具有一定数目质子和一定数目中子的一种原子。同位素指的是质子数相同中子数不同原子核不同核素间的互称,、和三种核素它们的质子数都是1,而中子数分别为0、1、2,所以三者互为同位素;
故选A。
二、选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
11. 下列物质属于共价化合物的是
A. O2 B. KCl C. H2O D. Mg
【答案】C
【解析】
【分析】一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物属于共价化合物。
【详解】A.O2单质中只含共价键,但属于单质,不是化合物,故A错误;
B.KCl中存在离子键和共价键,属于离子化合物,故B错误;
C.水分子中H与O原子之间只存在共价键,为共价化合物,故C正确;
D.Mg属于单质,不是化合物,故D错误。
答案选C。
12. 化学与生活、社会密切相关,下列有关说法不正确的是
A. 德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体
B. 复合膨松剂一般由碳酸盐类、酸性物质和助剂组成
C. 光化学烟雾、臭氧层空洞、温室效应的形成都与氮氧化物有关
D. 推广电动汽车和开展植树造林有利于环境保护
【答案】BC
【解析】
【详解】A.气溶胶、液溶胶和固溶胶都属于胶体,新型冠状病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体,故A正确;
B.复合膨松剂又名发酵粉,一般由碳酸氢钠等碳酸氢盐、酸性盐或者有机酸等酸性物质和淀粉、脂肪酸、食盐等助剂组成,作用是产生气体或使气体产生均匀,使面团疏松多孔,不属于碳酸盐类,故B错误;
C.化学烟雾、臭氧空洞的形成都与氮氧化物有关,温室效应的形成主要与二氧化碳有关,故C错误;
D.推广电动汽车,可以减少化石燃料的使用,有利于碳中和,植树造林过程中吸收二氧化碳,对“碳中和”目标的实现有积极作用,故D正确;
故选:BC。
13. X、Y、Z、W是原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和比为5:4。下列说法正确的是
A. 原子半径:r(W)>r(Z) >r(Y) >r(X)
B. Z的简单气态氢化物的热稳定性比Y的强
C. 由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D. 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
【答案】BD
【解析】
【分析】X、Y、Z、W是原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,则X为H、W为Na;X、W原子的电子数总和为12,Y、Z原子的电子数总和与X、W原子的电子数总和比为5:4,则Y、Z原子的电子数总和为15,则Y、Z分别为N和O。
【详解】A. 同一周期的元素的原子半径从左到右依次减小,则原子半径: r(N) >r(O),A说法不正确;
B. O的非金属性强于N,则O的简单气态氢化物的热稳定性比N的强,B说法正确;
C. 由X、Z组成的化合物可以是H2O,与由Z、W组成的化合物可以是Na2O2,两者发生瓜泩成氢氧化钠和氧气,两者不能发生化合反应,C说法不正确;
D. 由H、N、O三种元素组成的化合物可以是HNO3、NH3∙H2O、NH4NO3,其分别为酸、碱或盐,D说法正确。
本题选BD。
14. 向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是
A. a点时溶液中阳离子有Cu2+、Fe2+、Fe3+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度无法计算
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
【答案】CD
【解析】
【分析】由氧化性的强弱(Fe3+>Cu2+)及图象变化可知:①0~5.6gFe发生Fe+2Fe3+=3Fe2+,②0.56g~1.68gFe时,消耗铁1.12g,剩余物为1.28g,而1.28gCu的物质的量为0.02mol,此时发生Fe+Cu2+=Cu+Fe2+;③加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g-1.28g=0.56g,所以此时溶液中不含Cu2+,反应完全,以此来解答。
【详解】A.0~5.6gFe发生Fe+2Fe3+=3Fe2+,a点时溶液中阳离子为Cu2+、Fe2+和Fe3+,故A正确;
B.由图可知加入铁粉0.56g~1.68g时,n(Fe)= =0.02mol,剩余物为1.28g,即1.28gCu的物质的量为=0.02mol,此时发生Fe+Cu2+=Cu+Fe2+,故B正确;
C.由图象可知原溶液中Fe3+为0.02mol,即Fe2(SO4)3为0.01mol,n(SO)=3n[Fe2(SO4)3]=0.03mol,Cu2+为0.02mol,即CuSO4为0.02mol,n(SO)=n(CuSO4)=0.02mol,当加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加1.84g-1.28g=0.56g,溶液中不含Cu2+,溶液中溶质为FeSO4,n(SO)=0.02mol+0.03mol=0.05mol,SO守恒有n(FeSO4)=n(SO)=0.05mol,所以c点溶液中溶质的物质的量浓度为0.05mol÷0.1L=0.5mol/L,故C错误;
D.由上述分析可知原溶液中Fe2(SO4)3为0.01mol,CuSO4为0.02mol,所以原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比=物质的量之比为1:2,故D错误;
故答案选CD。
三、非选择题:本题共4小题,共54分。
15. 温室效应加剧引起近日全球各地出现极端天气,我国“十四五”规划中已明确提到“碳达峰”“碳中和”的目标,体现了大国担当,请回答下列问题:
(1)“碳达峰”“碳中和”的“碳”指的是___________(写名称)。
(2)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程式为:___________。该反应中还原剂是___________。
(3)陆地生态系统的土壤是二氧化碳、甲烷等温室气体的资源库。已知土壤胶体胶粒带负电荷,具有选择吸附能力,在土壤里施用含氮量相同的下列肥料,肥效较差的是___________(填字母序号)。
A. B. C. D.
(4)某化学兴趣小组同学将燃烧的镁条插入盛满的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,写出该反应方程式,并用双线桥分析该反应电子的得失及数目:______。
【答案】(1)二氧化碳
(2) ①. ②. 、 (3)C
(4)
【解析】
【小问1详解】
碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低,故碳是指二氧化碳。
【小问2详解】
二氧化碳和水反应生成甲烷和氧气,该反应的化学方程式为。该反应中还原剂是二氧化碳和水。
【小问3详解】
土胶体胶粒带负电荷,具有选择吸附能力,硝酸根带负电,互相排斥,吸收氮元素不充分,所以答案选C。
【小问4详解】
镁与反应,在已有知识基础上,根据元素组成分析,生成白色固体应该是,黑色物质是C,反应方程式及双线桥表示为:。
16. 下表是元素周期表的一部分,①~⑦代表七种元素,它们在元素周期表中的位置如下。
族 周期 | ⅠA |
|
|
|
|
|
| 0 |
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② | ③ |
|
|
|
3 | ④ |
|
| ⑤ |
| ⑥ | ⑦ |
|
请回答下列问题:
(1)元素⑥的原子结构示意图为_______,其最高正化合价为_______。
(2)元素②~⑦最高价氧化物的水化物中,碱性最强的是_______(填化学式),酸性最强的是_______(填化学式)。
(3)②、③、④三种元素中,原子半径最小的是_______(填元素符号)。
(4)元素①和⑦组成的化合物的水溶液与元素④的单质发生反应,其离子方程式为_______。
【答案】(1) ①. ②. +6
(2) ①. NaOH ②. HClO4
(3)N (4)
【解析】
【分析】根据元素的位置可知①~⑦的元素分别为H、C、N、Na、Si、S、Cl;
【小问1详解】
元素⑥为S,是16号元素,其原子结构示意图为,位于第VIA族,最高正化合价为+6;
【小问2详解】
金属性越强,对应的最高价氧化物的水化物的碱性越强,④Na的金属性最强,碱性最强的是NaOH,非金属性越强,对应的最高价氧化物的水化物的酸性越强,⑦Cl的非金属性最强,酸性最强的是HClO4;
【小问3详解】
电子层数越多的原子半径越大,电子层数相同的,核电荷数越大,半径越小,则原子半径最小的是③N;
【小问4详解】
①和⑦组成的化合物的水溶液为盐酸,与④的单质Na反应生成NaCl和H2,离子方程式为。
17. 实验室以石灰乳和氯气为原料制备漂白粉的过程如下:在烧瓶和烧杯中(实验装置如图1)均加入一定量石灰乳和水,搅拌,通入氯气和空气混合气体,反应。停止通入气体,充分搅拌,取出糊状物,避光,晾干,密封保存。
(1)石灰乳和氯气反应的化学方程式为_______。
(2)石灰乳吸收氯气放出热量.实验中控温的方法是_______。
(3)图1中通入空气的目的是_______,烧杯中石灰乳的作用是_______。
(4)在不控温的条件下,石灰乳吸收氯气的产物随时间的变化如图2所示。则制备漂白粉过程中发生的副反应的化学方程式为_______。
(5)漂白粉需要密封保存的原因是_______。
【答案】(1)2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2 +2H2O
(2)冷水浴 (3) ①. 推动氯气与石灰乳的接触,使其更充分反应,同时可以减慢反应速率,便于控制温度 ②. 吸收未反应的氯气,防止污染,提高氯气的利用率
(4)6Cl2+6Ca(OH)2=5CaCl2+ Ca(ClO3)2 +6H2O
(5)防止漂白粉与空气中的CO2反应而变质
【解析】
【分析】通入空气可将氯气推动进入三颈烧瓶中进行反应2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2 +2H2O,多余的氯气可用石灰乳吸收,既可以防止污染,反应又可得到漂白粉的主要成分,提高氯气的利用率;
【小问1详解】
石灰乳Ca(OH)2和氯气发生歧化反应生成CaCl2和Ca(ClO)2,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2 +2H2O;
【小问2详解】
石灰乳吸收氯气放出热量,为降低反应温度,实验中控温的方法是冷水浴;
【小问3详解】
图1中通入空气的目的是推动氯气与石灰乳的接触,使其更充分反应,同时可以减慢反应速率,便于控制温度;由于氯气有毒,装置末的烧杯中石灰乳的作用是吸收未反应的氯气,防止污染,提高氯气的利用率;
【小问4详解】
温度较高时,石灰乳和氯气反应生成另一个产物是Ca(ClO3)2,Cl元素从0价升到+5价,失去2×5=10mol电子,Cl元素化合价从0降低至-1价,生成CaCl2,得到2×1=2mol电子,根据得失电子守恒,则CaCl2前配5,结合原子守恒可得发生的副反应的化学方程式为6Cl2+6Ca(OH)2=5CaCl2+ Ca(ClO3)2 +6H2O;
【小问5详解】
因碳酸的酸性大于次氯酸,则Ca(ClO)2 能和空气中CO2、H2O发生反应生成HClO,且HClO光照或受热会发生分解,则漂白粉需要密封保存的原因是防止漂白粉与空气中的CO2反应而变质。
18. 混合物的分离提纯在生产、生活中有着重要的意义。已知某工业废水中含有大量的,还可能含有较多的、、、,以及部分污泥,通过下列流程可从该废水中回收晶体及固体单质。已知氧化性:。
(1)不需任何实验就可以确定可能存在的离子中___________(填离子符号)一定不存在。
(2)步骤1采用了___________操作。根据步骤2中得到固体混合物可以确定可能存在的离子中___________(填离子符号)一定存在。
(3)通过实验___________(填“能”或“不能”)确定是否存在。的存在对回收晶体的纯度___________(填“有”或“无”)影响,理由是___________。
(4)步骤3中加入的试剂X为___________,发生反应的离子方程式为___________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、烘干。
【答案】(1)、
(2) ①. 过滤 ②.
(3) ①. 不能 ②. 无 ③. 有氧化性,能被过量的还原为
(4) ①. 稀 ②.
(5)冷却结晶
【解析】
【分析】工业废水中含有大量的,与,与不能共存,故一定没有、;将废水过滤可以除去废水中的污泥;向溶液中加入过量的Fe,过滤后得到固体混合物,可以证明溶液中含有Cu2+,固体混合物为Fe和Cu,溶液2为FeSO4溶液;向固体混合物中加入试剂X,得到FeSO4溶液和固体单质,固体单质为Cu,则试剂X为稀硫酸,既能溶解部分铁,又不引入新杂质离子;FeSO4溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干得到。
【小问1详解】
工业废水中含有大量,与,与不能共存,故一定没有、;
【小问2详解】
步骤1分离固液混合物用过滤,步骤2中得到固体混合物可以确定原溶液中有,得到固体为铁和铜;
【小问3详解】
存在与否无法判断,有强氧化性,能被过量的铁还原为,故对的分离提纯无影响;
【小问4详解】
步骤3中加入的试剂为稀硫酸,既能溶解部分铁,又不引入新杂质离子,发生反应的离子方程式为:;
【小问5详解】
FeSO4溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干得到。
2023长沙浏阳高一上学期期末考试化学含答案: 这是一份2023长沙浏阳高一上学期期末考试化学含答案,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2023长沙浏阳高二上学期期末考试化学试题含解析: 这是一份2023长沙浏阳高二上学期期末考试化学试题含解析,文件包含湖南省长沙市浏阳市2022-2023学年高二上学期期末考试化学试题含解析docx、湖南省长沙市浏阳市2022-2023学年高二上学期期末考试化学试题无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
2023长沙浏阳高二上学期期末考试化学试题含解析: 这是一份2023长沙浏阳高二上学期期末考试化学试题含解析,文件包含湖南省长沙市浏阳市2022-2023学年高二上学期期末考试化学试题含解析docx、湖南省长沙市浏阳市2022-2023学年高二上学期期末考试化学试题无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。











