
所属成套资源:高考化学二轮复习教案专题突破 (含解析)
高考化学二轮复习教案专题突破(七) 化学反应速率和化学平衡图像的分析(含解析)
展开
这是一份高考化学二轮复习教案专题突破(七) 化学反应速率和化学平衡图像的分析(含解析),共19页。
专题突破(七) 化学反应速率和化学平衡图像的分析
化学反应速率和平衡的图像及分析是高考考查的重点,此类试题将抽象的理论知识图像化,既能考查考生化学反应速率和平衡的相关知识,又能考查学生读图、识图,并应用知识解决综合问题的能力,要求考生获取有关信息、识别有效证据、推测反应结果、归纳总结规律,体现《中国高考评价体系》对于“学习掌握”“思维方法”等化学科核心素养的要求。
分析、解答化学反应速率和化学平衡图像题的思维流程如下:
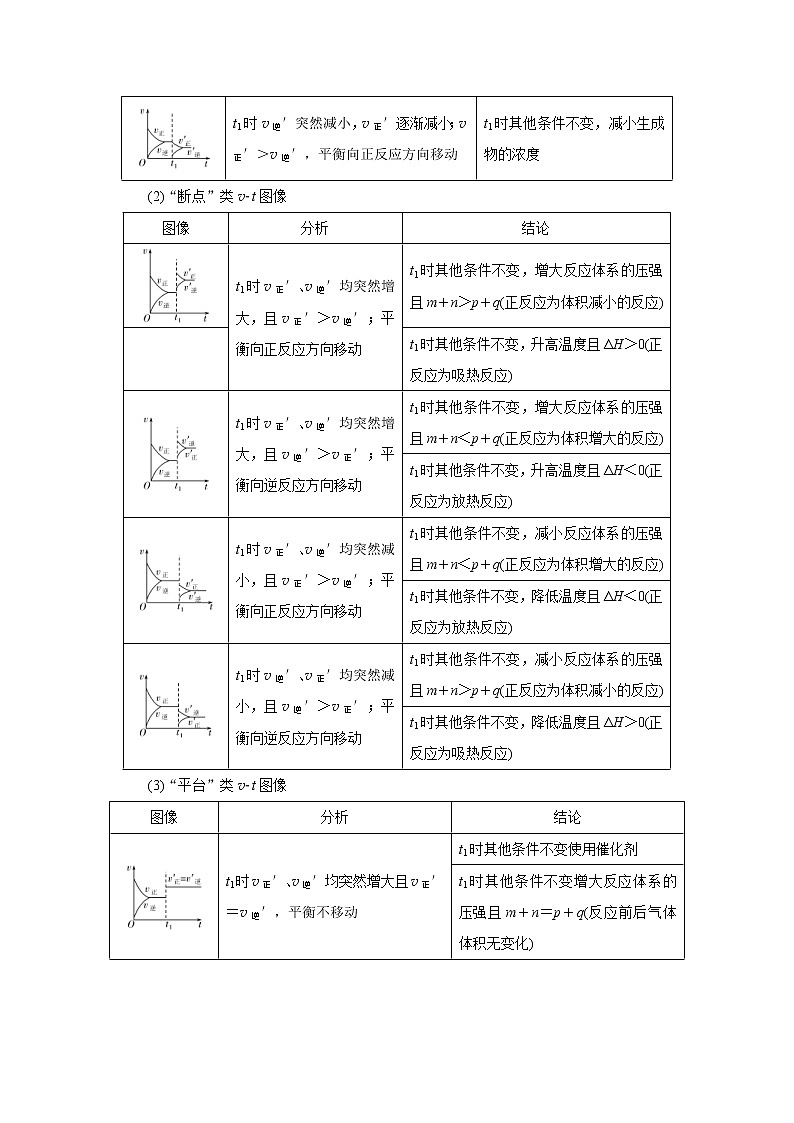
1.化学反应速率图像及分析
(1)“渐变”类vt图像
图像
分析
结论
t1时v正′突然增大,v逆′逐渐增大;v正′>v逆′,平衡向正反应方向移动
t1时其他条件不变,增大反应物的浓度
t1时v正′突然减小,v逆′逐渐减小;v逆′>v正′,平衡向逆反应方向移动
t1时其他条件不变,减小反应物的浓度
t1时v逆′突然增大,v正′逐渐增大;v逆′>v正′,平衡向逆反应方向移动
t1时其他条件不变,增大生成物的浓度
t1时v逆′突然减小,v正′逐渐减小;v正′>v逆′,平衡向正反应方向移动
t1时其他条件不变,减小生成物的浓度
(2)“断点”类vt图像
图像
分析
结论
t1时v正′、v逆′均突然增大,且v正′>v逆′;平衡向正反应方向移动
t1时其他条件不变,增大反应体系的压强且m+n>p+q(正反应为体积减小的反应)
t1时其他条件不变,升高温度且ΔH>0(正反应为吸热反应)
t1时v正′、v逆′均突然增大,且v逆′>v正′;平衡向逆反应方向移动
t1时其他条件不变,增大反应体系的压强且m+n<p+q(正反应为体积增大的反应)
t1时其他条件不变,升高温度且ΔH<0(正反应为放热反应)
t1时v正′、v逆′均突然减小,且v正′>v逆′;平衡向正反应方向移动
t1时其他条件不变,减小反应体系的压强且m+n<p+q(正反应为体积增大的反应)
t1时其他条件不变,降低温度且ΔH<0(正反应为放热反应)
t1时v逆′、v正′均突然减小,且v逆′>v正′;平衡向逆反应方向移动
t1时其他条件不变,减小反应体系的压强且m+n>p+q(正反应为体积减小的反应)
t1时其他条件不变,降低温度且ΔH>0(正反应为吸热反应)
(3)“平台”类vt图像
图像
分析
结论
t1时v正′、v逆′均突然增大且v正′=v逆′,平衡不移动
t1时其他条件不变使用催化剂
t1时其他条件不变增大反应体系的压强且m+n=p+q(反应前后气体体积无变化)
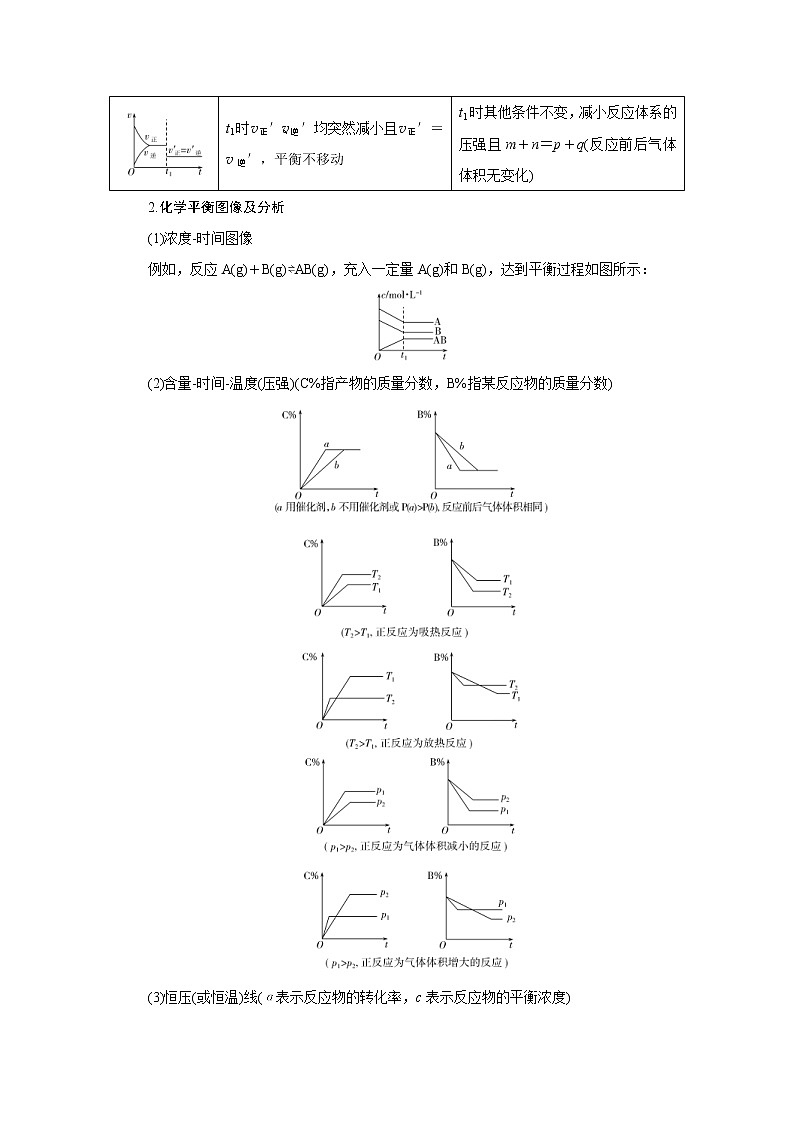
t1时v正′、v逆′均突然减小且v正′=v逆′,平衡不移动
t1时其他条件不变,减小反应体系的压强且m+n=p+q(反应前后气体体积无变化)
2.化学平衡图像及分析
(1)浓度时间图像
例如,反应A(g)+B(g)⇌AB(g),充入一定量A(g)和B(g),达到平衡过程如图所示:
(2)含量时间温度(压强)(C%指产物的质量分数,B%指某反应物的质量分数)
(3)恒压(或恒温)线(α表示反应物的转化率,c表示反应物的平衡浓度)
图①,若则正反应为气体体积减小的反应,p1>p2>p3,ΔH<0;
图②,正反应为气体体积增大的反应,若T1>T2,则正反应为放热反应。
(4)几类特殊图像
①对于化学反应mA(g)+nB(g)pC(g)+qD(g),M点前,表示从反应物开始,v正>v逆;M点为刚达到平衡点(如下图);M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。
②对于化学反应mA(g)+nB(g)pC(g)+qD(g),L线上所有的点都是平衡点(如下图)。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以,E点v正>v逆;则L线的右下方(F点),v正<v逆。
(2021·山东日照一模)已知反应:CH2===CHCH3(g)+Cl2(g)CH2===CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )
A.图甲中ω1>1
B.图乙中,线A表示正反应的平衡常数
C.在恒容容器中进行,压强不变时反应达到平衡状态
D.当温度为T1、ω=2时,Cl2的转化率为33.3%
D [温度一定时,增大,平衡时丙烯的体积分数减小,故图甲中ω1<1,A项错误。由图甲可知,一定时,升高温度,丙烯的体积分数增大,说明升高温度,平衡逆向移动,则该反应的ΔH<0;升高温度,平衡逆向移动,则平衡常数K减小,故图乙中线A代表逆反应的平衡常数,B项错误。该反应前后气体计量数和相等,气体总物质的量不变,故恒容时气体压强始终不变,不能根据压强判断是否达到平衡状态,C项错误。由图乙可知,T1时正、逆反应平衡常数均为1,ω==2,设n(Cl2)=2 mol,n(CH2===CHCH3)=1 mol,平衡时转化的Cl2为x mol,容器的容积为1 L,则有
CH2===CHCH3(g)+Cl2(g)CH2===CHCH2Cl(g)+HCl(g)
起始浓度
/mol·L-1 1 2 0 0
转化浓度
/mol·L-1 x x x x
平衡浓度
/mol·L-1 1-x 2-x x x
则T1时平衡常数K==1,解得x= mol,故Cl2的转化率为×100%≈33.3%,D项正确。]
(2021·河北邢台调研)在一定温度下,向2 L恒容密闭容器中充入1 mol A,发生2A(g) B(g)+C(g)反应。反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
A.反应在0~50 s的平均速率v(C)=1.6×10-3 mol·L-1·s-1
B.该温度下,反应的平衡常数K=0.025 mol·L-1
C.保持其他条件不变,升高温度,平衡时c(B)=0.09 mol·L-1,则该反应的ΔH<0
D.反应达平衡后,再向容器中充入1 mol A,该温度下再达到平衡时,A的转化率不变
B [0~50 s内c(C)增大0.08 mol·L-1,则有v(C)==1.6×10-3 mol·L-1·s-1,A项正确;达到平衡时,c(C)=0.10 mol·L-1,结合反应可知,平衡时A、B的平衡浓度分别为0.30 mol·L-1、0.10 mol·L-1,则该温度下,反应的平衡常数K==,B项错误;其他条件不变,升高温度,平衡时c(B)=0.09 mol·L-1<0.10 mol·L-1,说明平衡逆向移动,则该反应的ΔH<0,C项正确;平衡后再充入1 mol A与保持n(A)不变,同时缩小容器容积是等效平衡,而缩小容积过程,由于反应前后气体体积不变,所以平衡不移动,故A的转化率不变,D项正确。]
(2021·黑龙江哈尔滨三中检测)在密闭容器中进行反应:X(g)+2Y(g) 2Z(g) ΔH>0。下图能正确表示该反应有关物理量变化规律的是( )
C [该反应为吸热反应,升高温度平衡正向移动,正反应速率大于逆反应速率,正反应速率在上方,与图像不符, A项错误;升高温度平衡正向移动,Z%增大,则200 ℃时Z%大,与图像不符,B项错误;该反应为气体体积减小的吸热反应,增大压强、升高温度,平衡均正向移动,X的转化率大,与图像一致,C项正确;催化剂对平衡移动无影响,可加快反应速率,但平衡常数与温度有关,恒温条件K值不会随时间发生变化,与图像不符,D项错误。]
1.(2021·河南豫南九校联考)有可逆反应:A(g)+3B(g)2C(g) ΔHp2>p1
C.1 100 ℃时该反应的平衡常数约为1.64
D.压强为p4时,在y点:v正>v逆
A [p1、p2、p3、p4是四条等压线,由图像可知,压强一定时,温度越高,CH4的平衡转化率越高,故正反应为吸热反应,ΔH>0,A项错误;该反应为气体分子数增加的反应,压强越高,甲烷的平衡转化率越小,故压强p4>p3>p2>p1,B项正确;压强为p4、温度为1 100 ℃时,甲烷的平衡转化率为80.00%,故平衡时各物质的浓度分别为c(CH4)=0.02 mol·L-1,c(CO2)=0.02 mol·L-1,c(CO)=0.16 mol·L-1,c(H2)=0.16 mol·L-1,即平衡常数K=≈1.64,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。]
4.(2021·四川绵阳诊断)在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH。在某压强下起始时按不同氢碳比投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )
A.该反应的ΔH>0
B.氢碳比:①②>③,B项错误;正反应是气体体积减小的反应,因此其他条件不变的情况下,增大容器的体积,压强减小,平衡向逆反应方向移动,可降低CO2的转化率,C项错误;根据图像可知,400 K时曲线③中CO2的转化率是50%,这说明消耗CO2 1 mol·L-1,则消耗氢气3 mol·L-1,生成乙醇和水蒸气分别是0.5 mol·L-1、1.5 mol·L-1,剩余CO2和氢气分别是1 mol·L-1、1 mol·L-1,该温度下平衡常数K=≈1.7,D项正确。]
5.(2021·安徽芜湖检测)将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应:NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
A.C点对应状态的平衡常数K(C)=10-3.638
B.该反应的ΔH>0
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30 ℃时,B点对应状态的v(正)0,B项正确;反应物是固体,生成物中NH3和CO2的物质的量之比为2∶1,则NH3的体积分数始终为,不能判断是否达到平衡状态,C项错误;图中B点纵坐标小于30 ℃时-lgK的值,则此时c(CO2)·c2(NH3)>K,反应逆向进行,故B点对应状态的v(正)
相关教案
这是一份高考化学二轮复习教案专题突破(十四) 化学实验装置的选择及创新使用(含解析),共6页。
这是一份高考化学二轮复习教案专题突破(十三) 化学实验操作的规范描述(含解析),共6页。
这是一份高考化学二轮复习教案专题突破(十六) 晶体结构的分析与计算(含解析),共15页。









