




所属成套资源:2022年高考化学一轮复习课件 (含解析)
2022年高考化学一轮复习课件 第4章 第23讲 氮及其化合物 (含解析)
展开
这是一份2022年高考化学一轮复习课件 第4章 第23讲 氮及其化合物 (含解析),共60页。PPT课件主要包含了复习目标,考点一氮及其氧化物,真题演练明确考向,课时精练巩固提高,考点三氨铵盐,内容索引,知识梳理·夯基础,氮的固定,N2O4,N2O5等内容,欢迎下载使用。
1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及 应用。2.了解氮的化合物对环境的影响。
考点二 典型的氧化性酸——硝酸
微专题11 喷泉实验及拓展应用
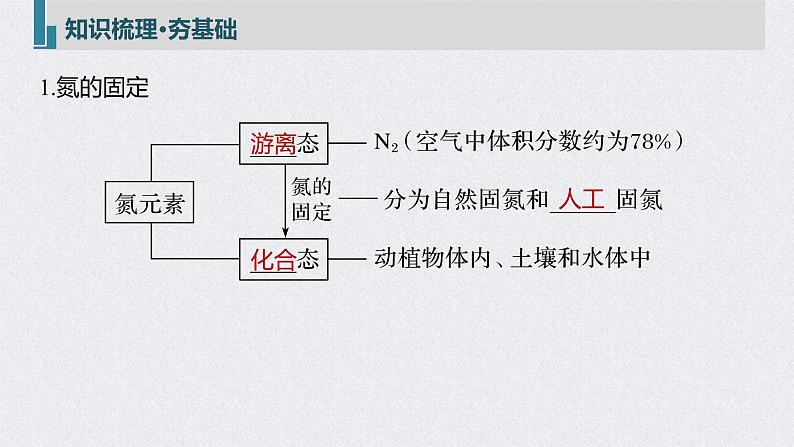
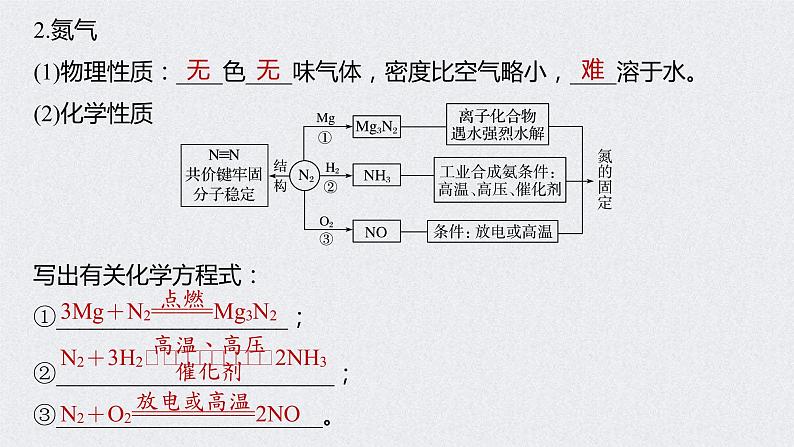
2.氮气(1)物理性质:____色____味气体,密度比空气略小,____溶于水。(2)化学性质
写出有关化学方程式:①____________________;②________________________;③_______________________。
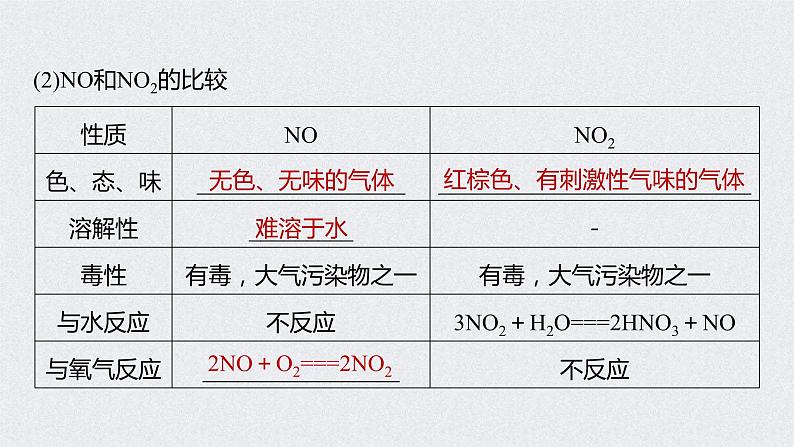
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1―→+5价都有对应的氧化物,如N2O、_____、N2O3、NO2(或______)、N2O5,其中属于酸性氧化物的是N2O3、______。
(2)NO和NO2的比较
红棕色、有刺激性气味的气体
2NO+O2===2NO2
提醒 ①NO2与N2O4存在下列平衡:2NO2 N2O4,因此实验测得NO2的平均相对分子质量总大于46。②验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色。
4.氮氧化物对环境的污染及防治(1)常见的污染类型①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。④NO与血红蛋白结合使人中毒。
(2)常见的NOx尾气处理方法①碱液吸收法工业尾气中NOx常用碱液吸收处理,NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。②催化转化法在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2),或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
(1)固氮反应一定属于氧化还原反应( )错因:______________________________________________________。(2)N2与O2在放电条件下直接化合成NO2( )错因:__________________________。(3)用向上排空气法收集铜粉与稀硝酸反应产生的气体( )错因:________________________________________________________。
N2与O2在放电条件下生成NO
Cu与稀硝酸生成NO,NO与空气中的O2反应,不能用排空气法收集
(4)NO2溶于水时,NO2是氧化剂,水是还原剂( )错因:_______________________________________。(5)可用NO2与水反应制取硝酸,故NO2是酸性氧化物( )错因:____________________________________________________。
NO2与H2O反应,NO2既是氧化剂又是还原剂
NO2与H2O反应生成HNO3和NO,所以NO2不是酸性氧化物
1.结合N2、NO、NO2的化学性质,用化学方程式解释“雷雨发庄稼”的科学道理。
答案 ①N2+O2 2NO②2NO+O2===2NO2③3NO2+H2O===2HNO3+NO
2.NO2和溴蒸气均为红棕色气体,你用哪些实验方法鉴别二者?写出所用试剂和区别的现象。方案一:试剂___________,现象____________________________________________________。方案二:试剂____________,现象__________________________________________________________。方案三:试剂_______,现象_______________________________________________________________。
NO2中AgNO3溶液无明显变化,溴蒸
NO2中CCl4(或汽油)仍为无色,溴蒸
气中CCl4(或汽油)的颜色加深
NO2中蒸馏水不变色,溴蒸气中水的颜色
加深(其他合理的答案均正确)
题组一 氮及氧化物的性质和应用1.(2020·通化高三月考)下列有关氮气的说法正确的是A.氮气是由氮原子构成的双原子分子,所以化学性质不活泼B.1 ml N2可与3 ml H2完全反应生成2 ml NH3C.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中发生的反应之一 是N2+2O2===2NO2D.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大 气污染物
解析 A项,氮原子最外层有5个电子,氮与氮形成三对共用电子对,达8电子的稳定结构;B项,氮气与氢气反应生成氨气是可逆反应;C项,氮气与氧气在放电的条件下生成一氧化氮;D项,NO和氧气反应生成NO2;NO2和水反应生成NO。
2.下列说法中错误的是A.工业上利用合成氨实现人工固氮涉及氧化还原反应B.通过灼热的铜粉,可以除去N2中的O2C.除去NO中的NO2气体的方法是将气体依次通入盛有水和浓H2SO4的洗 气瓶中D.NO2与H2O的反应中氧化剂与还原剂的质量之比为2∶1
解析 NO2与H2O的反应中氧化剂与还原剂的质量之比为1∶2。
3.如图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内物质的密度为
A.等于1.369 g·L-1B.等于2.054 g·L-1C.在1.369 g·L-1和2.054 g·L-1之间D.大于2.054 g·L-1
解析 一氧化氮与氧气恰好发生反应生成了二氧化氮,2NO + O2 === 2NO22 1 222.4 mL 11.2 mL 22.4 mL反应后生成了22.4 mL二氧化氮,假设二氧化氮的体积不变,
因存在转化平衡:2NO2 N2O4,则混合气体的体积小于22.4 mL,所以容器中气体的密度应大于2.054 g·L-1。
题组二 氮氧化物对环境的污染及防治4.(2020·湖南怀化统一考试)化学与生产、生活、环境等社会实际密切相关。下列相关叙述正确的是A.SO2、CO2、NO2都是可形成酸雨的气体B.75%酒精消毒原理和“84”消毒液(主要成分NaClO)消毒的原理相同C.纳米铁粉通过物理吸附去除污水中Hg2+、Pb2+等重金属离子D.汽车尾气中含有的氮氧化物,会加剧酸雨的形成
解析 SO2和NO2都是可形成酸雨的气体,CO2不能形成酸雨,但会造成温室效应,A项错误;75%的酒精消毒的原理是使蛋白质发生变性,“84”消毒液是利用其主要成分NaClO的强氧化性杀菌消毒,原理不相同,B项错误;纳米铁粉能有效地处理污水中的Hg2+、Pb2+等重金属离子,与其还原性有关,C项错误。
5.工业上常采用生物硝化法将 转化为 来处理氨氮废水,工作流程如图,下列说法错误的是
A.生物硝化法处理废水,会导致水体pH逐渐下降: +2O2=== + 2H++H2OB.长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化C.检验 所需的试剂是浓NaOH溶液、湿润的蓝色石蕊试纸D.微生物保持活性的pH范围为7~9,可以加入石灰石来调节水体的pH
解析 NH4Cl水解呈酸性,长期过量使用会导致土壤酸化,也会导致水体富营养化,B项正确;检验 应使用红色石蕊试纸,C项错误;生物硝化法处理废水会使水体呈酸性,可以加入石灰石与H+反应来调节水体的pH,D项正确。
6.(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:__________________________。(2)用氨可将氮氧化物转化为无毒气体。如4NH3+6NO 5N2+6H2O。写出氨气转化NO2的化学方程式:_____________________________,该反应中氧化产物与还原产物的质量之比为_____。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:____________________________________。②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是________。
2NO2+2NaOH===NaNO3+NaNO2+H2O
1.物理性质硝酸是无色易挥发的液体,有刺激性气味。2.化学性质
(1)不稳定性反应:_______________________________________。
(2)强氧化性硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。按要求完成下列反应的方程式:①与金属反应:稀硝酸与铜反应:__________________________________________;浓硝酸与铜反应:_________________________________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
②与非金属反应:浓硝酸与C的反应:_______________________________________。③与还原性化合物反应:硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。稀硝酸与FeSO4溶液反应的离子方程式:______________________________________。
(3)与有机物反应①硝化反应(与 反应):__________________________________;②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
(1)实验室也可用锌粒与稀硝酸制取氢气( )错因:_______________________________________。(2)常温下,铁、铝在浓硝酸中的钝化为化学变化( )错因:______________________________________________________。(3)可用稀硝酸与FeS固体反应制取H2S( )错因:________________________________。(4)铜溶于稀硝酸不能体现硝酸的酸性( )错因:______________________________________________。
HNO3有强氧化性,与金属反应时不放出H2
HNO3会将-2价的硫氧化成单质硫
Cu与HNO3反应,生成Cu(NO3)2,体现HNO3的酸性
(5)在酸性条件下, 与I-、Fe2+、 等离子能大量共存( )错因:_________________________________________________________________。
在酸性条件下有强氧化性,会将I-、Fe2+、 等还原性
(1)HNO3与金属反应一般不能产生H2。(2)硝酸的还原产物不只有NO2和NO,很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。(3)硝酸与金属反应时既表现氧化性又表现酸性。(4)涉及HNO3的离子反应常见的易错问题①忽视 在酸性条件下的强氧化性。在酸性条件下 不能与Fe2+、I-、 、S2-等还原性较强的离子大量共存。②在书写离子方程式时,忽视HNO3的强氧化性,将氧化还原反应简单地写成复分解反应,如易错易混辨析中的(3)。
1.将浓硝酸存放在无色试剂瓶中,一段时间后观察到溶液变黄,用化学方程式解释变黄的原因,由此得到启示,如何保存浓硝酸?
答案 4HNO3(浓) 2H2O+4NO2↑+O2↑,浓硝酸应保存在棕色试剂瓶中,并置于阴凉处。
2.用动态观点理解Cu与浓HNO3的反应向一定量的浓硝酸中加入过量的铜片。①反应开始阶段产生_____色气体,化学方程式为___________________________________________。②反应进行一段时间后又产生无色气体,此时的化学方程式为_____________________________________________。③待反应停止后,再加入少量的稀硫酸,这时Cu片上又有气泡产生,原因是_____________________________________________________________________________。
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,
题组一 硝酸的性质及应用1.(2019·潍坊期末)硝酸是化学实验室中最常用的试剂之一,下列有关硝酸的说法不正确的是A.浓硝酸和氯水用棕色试剂瓶保存,原理相同B.将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成C.常温下铁和铂都不溶于浓硝酸,原理相同D.浓硝酸溅到皮肤上,皮肤会变黄
解析 A项,HNO3和氯水中的HClO见光都易分解,都应避光保存,正确;B项,浓HNO3和浓氨水都具有挥发性,HNO3与NH3化合生成白色固体小颗粒NH4NO3,正确;C项,常温下,铁在浓硝酸中钝化,而Pt与浓硝酸不反应,原理不同,错误;D项,浓HNO3能使蛋白质显黄色,正确。
2.将相同质量的铜分别与足量的浓硝酸、稀硝酸反应,下列叙述正确的是A.硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少B.反应中转移的电子总数:稀硝酸少于浓硝酸C.试管内壁上的铜用浓硝酸除去比用稀硝酸好,因为反应速率快D.两者用排水法收集的气体的体积相同
解析 铜完全反应,在进行相关计算时以铜为标准,等质量的铜在反应中失去的电子数相同,生成的Cu(NO3)2的量相同,浓硝酸被还原为NO2,化合价由+5降到+4,每个氮原子只得到1个电子,稀HNO3被还原时每个氮原子得到3个电子,故被还原的浓硝酸多、稀硝酸少,生成的NO2也比NO多。用排水法收集气体时,由于会发生反应:3NO2+H2O=== 2HNO3+NO,故两种情况收集到的气体一样多。
3.某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2B.③中反应的离子方程式为3Cu+ +8H+===3Cu2++2NO↑+4H2OC.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸的强D.由上述实验可知,Cu在常温下既可与稀硝酸反应,又可与稀硫酸反应
解析 Cu与稀硝酸发生反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,稀硝酸被还原为NO,NO遇空气中的O2生成NO2,故试管口有红棕色气体产生,A错误;③中溶液含有 ,滴加稀硫酸后,Cu、 、H+继续反应生成NO,B正确;
③中铜片继续溶解,是因为稀硫酸提供H+,与 形成HNO3,继续与Cu反应,C错误;Cu是不活泼金属,在常温下,可与稀硝酸反应,但不能与稀硫酸反应,D错误。
题组二 硝酸反应产物综合实验探究题
F是一半空的注射器。请回答有关问题:(1)设计装置A的目的是_______________________________________________________________。
产生CO2,赶走装置中的空气,防止因NO与O2反
4.(2020·桂林高三测试)某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),
应生成NO2而产生干扰
(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸并微热,观察到装置B中的现象是______________________________________________________;B中反应的离子方程式为___________________________________________。
Cu丝表面产生气泡,稀硝酸液面上方仍为无色,
3Cu+8H++ ===3Cu2++
(3)装置E和F的作用是_______________;为实现此作用,其操作方法是_________________________________________________________。(4)装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有_________的功能。
将注射器中的空气推入E中,若气体变为红棕色则说明生成了NO
1.氨的分子结构和物理性质
提醒 ①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
3.铵盐及 的检验(1)铵盐的物理性质铵盐都是____色固体,均易溶于水。
4.氨的实验室制法(1)加热固态铵盐和碱的混合物
①将湿润的红色石蕊试纸置于试管口,试纸变____;②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
用___________法。收集时,一般在管口塞一团棉花球,可减小NH3与空气的对流速率,收集到纯净的NH3
(2)实验室制取氨的其他方法
(1)液氨制冷、碘的升华、NH4Cl气化都不涉及化学变化( )错因:_______________________________________________。(2)能用加热法除去NaCl中的NH4Cl的原因是NH4Cl为强酸弱碱盐( )错因:_________________________________。
NH4Cl气化是NH4Cl分解生成NH3与HCl,是化学变化
原因是NH4Cl受热分解生成气体挥发
(3)现有1 ml·L-1的氨水,则该溶液中NH3·H2O的浓度是1 ml·L-1( )错因:_______________________________________________。(4)浓氨水可检验氯气管道是否漏气( )错因:______________________________________________________。
氨水中还含有NH3、 ,故c(NH3·H2O)
相关课件
这是一份新高考化学一轮复习精品课件 第5章 第27讲 氮及其化合物的转化关系 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,缺少尾气处理装置,观察气泡的速,真题演练明确考向,A或B,dcfei,红棕色气体颜色,慢慢变浅,NO2+8NH3等内容,欢迎下载使用。
这是一份2024年高考化学一轮总复习 第4单元 第4讲 氮及其化合物 课件,共60页。PPT课件主要包含了第4讲氮及其化合物,共用电子对,共价三键N≡N,高压催化剂,放电或高温,N2O3,N2O5,考点二氨和铵盐,NH3,刺激性等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习第4章非金属及其化合物第4讲氮及其化合物课件









