





所属成套资源:2022年高考化学一轮复习课件 (含解析)
2022年高考化学一轮复习课件 第7章 第34讲 化学平衡状态 化学平衡的移动 (含解析)
展开
这是一份2022年高考化学一轮复习课件 第7章 第34讲 化学平衡状态 化学平衡的移动 (含解析),共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,同一条件,质量或浓度,2建立,3平衡特点,错误的写明原因等内容,欢迎下载使用。
1.了解化学反应的可逆性及化学平衡的建立。2.掌握化学平衡的特征。3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影 响,能用相关理论解释其一般规律。4.了解化学平衡的调控在生活、生产和科学研究领域中的重要 作用。
考点一 可逆反应与化学平衡建立
考点二 化学平衡的移动
微专题18 应用“等效平衡”判断平衡移动的结果
1.可逆反应(1)定义在 下,既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。(2)特点①二同:a.相同条件下;b.正、逆反应同时进行。②一小:反应物与生成物同时存在;任一组分的转化率都 (填“大于”或“小于”)100%。
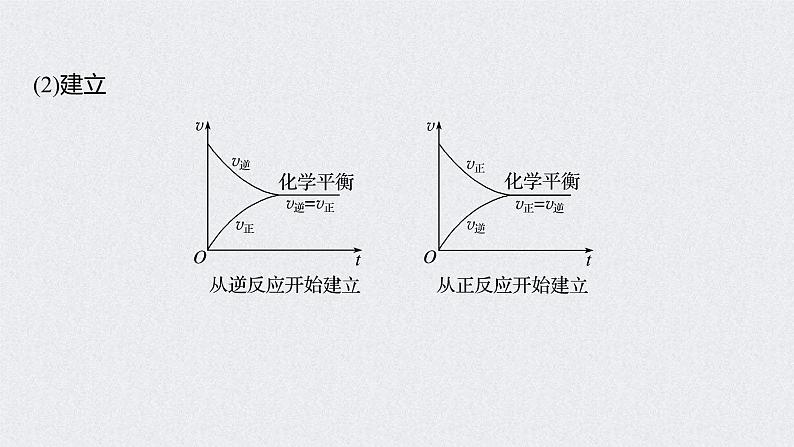
(3)表示在方程式中用“ ”表示。2.化学平衡状态(1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的 保持不变的状态。
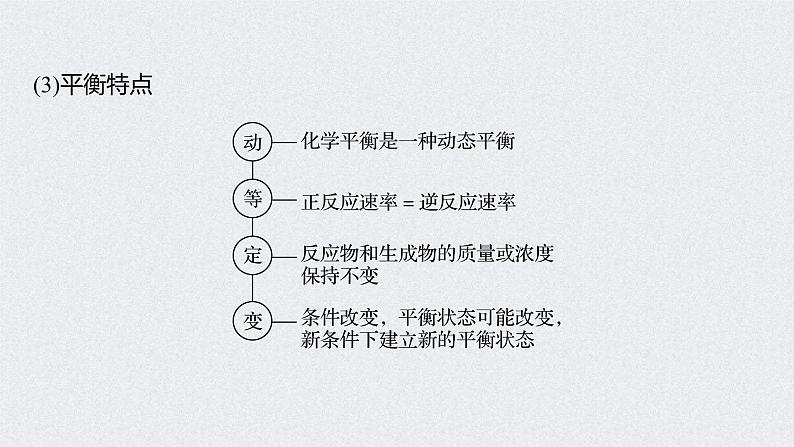
3.判断化学平衡状态的两种方法(1)动态标志:v正=v逆≠0①同种物质:同一物质的生成速率等于消耗速率。②不同物质:必须标明是“异向”的反应速率关系。如aA+bB
(2)静态标志:各种“量”不变①各物质的质量、物质的量或浓度不变。②各物质的百分含量(物质的量分数、质量分数等)不变。③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量为“不变量”,则不能作为平衡标志。
(1)反应2NaHCO3 Na2CO3+CO2↑+H2O、Na2CO3+CO2+H2O===2NaHCO3互为可逆反应( )错因:___________________________。(2)化学反应达到平衡后,反应物和生成物的浓度或百分含量相等( )错因:___________________________________________________________________________。
可逆反应的反应条件必须相同
化学反应达到平衡后,反应物或生成物的浓度或百分含量应保持不变,不一定相等
(3)在1 L的密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g),当容器中气体的颜色保持不变时,说明反应已达到平衡状态( )错因:________________________________________________________。(4)对于反应H2(g)+I2(g) 2HI(g),当压强不变时,反应达到平衡状态( )错因:___________________________________________________________________________。
该反应为反应前后气体分子数保持不变的可逆反应,反应过程中压强始终保持不变
1.向含有2 ml SO2的容器中通入过量O2发生2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·ml-1(Q>0),充分反应后生成SO3的物质的量_____(填“<”“>”或“=”,下同)2 ml,SO2的物质的量______0 ml,转化率______100%,反应放出的热量______ Q kJ。
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的浓度之比等于化学计量数之比;⑦某种气体的百分含量(1)能说明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是_________(填序号,下同)。(2)能说明I2(g)+H2(g) 2HI(g)达到平衡状态的是______。(3)能说明2NO2(g) N2O4(g)达到平衡状态的是___________。(4)能说明C(s)+CO2(g) 2CO(g)达到平衡状态的是____________。
(5)能说明NH2COONH4(s) 2NH3(g)+CO2(g)达到平衡状态的是_______。(6)能说明5CO(g)+I2O5(s) 5CO2(g)+I2(s)达到平衡状态的是_______。3.若上述题目中的(1)~(4)改成一定温度下的恒压密闭容器,结果又如何?(1)___________。(2)__________。(3)____________。(4)____________。
规避“2”个易失分点(1)化学平衡状态判断“三关注”关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2)不能作为“标志”的四种情况①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。②恒温恒容下的体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g) H2(g)+I2(g)。③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g) H2(g)+I2(g)。④全是气体参加的反应,恒容条件下体系的密度保持不变。
题组一 “极端转化”确定各物质的量1.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 ml·L-1、0.3 ml·L-1、0.2 ml·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是A.Z为0.3 ml·L-1 B.Y2为0.4 ml·L-1C.X2为0.2 ml·L-1 D.Z为0.4 ml·L-1
2.(2019·长沙一中月考)一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 ml·L-1、0.3 ml·L-1、0.08 ml·L-1,则下列判断正确的是A.c1∶c2=3∶1B.平衡时,Y和Z的生成速率之比为2∶3C.X、Y的转化率不相等D.c1的取值范围为0<c1<0.14 ml·L-1
解析 平衡浓度之比为1∶3,转化浓度之比亦为1∶3,故c1∶c2=1∶3,A、C不正确;平衡时Y生成表示逆反应速率,Z生成表示正反应速率且v生成(Y)∶v生成(Z)应为3∶2,B不正确;由可逆反应的特点可知0<c1<0.14 ml·L-1。
极端假设法确定各物质浓度范围上述题目1可根据极端假设法判断,假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。假设反应正向进行到底:X2(g)+Y2(g) 2Z(g)起始浓度(ml·L-1) 0.1 0.3 0.2改变浓度(ml·L-1) 0.1 0.1 0.2终态浓度(ml·L-1) 0 0.2 0.4
假设反应逆向进行到底:X2(g)+Y2(g) 2Z(g)起始浓度(ml·L-1) 0.1 0.3 0.2改变浓度(ml·L-1) 0.1 0.1 0.2终态浓度(ml·L-1) 0.2 0.4 0平衡体系中各物质的浓度范围为X2∈(0,0.2),Y2∈(0.2,0.4),Z∈(0,0.4)。
题组二 化学平衡状态的判断3.(2020·衡阳高三调研)反应N2(g)+3H2(g) 2NH3(g) ΔHv逆:平衡向 移动。(2)v正=v逆:反应达到平衡状态, 平衡移动。(3)v正<v逆:平衡向 移动。
4.影响化学平衡的外界因素根据化学平衡原理解答下列问题:在体积不变的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,只改变一种外界条件,完成下表:
5.化学平衡中的特殊情况(1)当反应混合物中存在与其他物质不相混溶的固体或液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或液体的量,对化学平衡没影响。(2)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。(3)充入惰性气体与平衡移动的关系①恒温、恒容条件原平衡体系 体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件原平衡体系 容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小(等效于减压)
6.勒夏特列原理及运用如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。本原理也称为平衡移动原理。
(1)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动( )错因:_______________________________________________________。(2)升高温度,平衡向吸热反应方向移动,此时v放减小,v吸增大( )错因:________________________。(3)化学平衡正向移动,反应物的转化率一定增大( )错因:__________________________________________________________________________________________________________。
化学反应速率改变,化学平衡不一定发生移动,如加入催化剂
升高温度,v放、v吸均增大
(4)向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅( )错因:_____________________________________________________。(5)对于2NO2(g) N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅( )错因:____________________________________________________________________________。
KCl没有参与反应,加入KCl固体,平衡不移动,颜色不变
因为压缩体积,平衡右移,但c(NO2)仍大于原来的浓度,所以混合气体的颜色变深
1.化学平衡移动的目的是“减弱”外界条件的改变,而不是消除“外界条件的改变”,即“减弱而不抵消”。对于一定条件下的可逆反应甲:A(g)+B(g) C(g) ΔH<0乙:A(s)+B(g) C(g) ΔH<0丙:A(g)+B(g) 2C(g) ΔH>0
达到化学平衡后,改变条件,按要求回答下列问题:(1)升温,平衡移动方向分别为(填“向左”“向右”或“不移动”)甲_______;乙_______;丙_______。此时反应体系的温度均比原来_____(填“高”或“低”)。混合气体的平均相对分子质量变化分别为(填“增大”“减小”或“不变”)甲________;乙________;丙________。
(2)加压,使体系体积缩小为原来的①平衡移动方向分别为(填“向左”“向右”或“不移动”)甲________;乙________;丙________。②设压缩之前压强分别为p甲、p乙、p丙,压缩后压强分别为p′甲、p′乙、p′丙,则p甲与p′甲,p乙与p′乙,p丙与p′丙的关系分别为甲________________;乙___________;丙___________。③混合气体的平均相对分子质量变化分别为(填“增大”“减小”或“不变”)甲________;乙________;丙________。
2.(1)可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
解析 该反应为气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
4.在压强为0.1 MPa、温度为300 ℃条件下,a ml CO与3a ml H2的混合气体在催化剂作用下发生反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH<0。(1)平衡后将容器的容积压缩到原来的一半,其他条件不变,对平衡体系产生的影响是______(填字母,下同)。A.c(H2)减小B.正反应速率加快,逆反应速率减慢C.反应物转化率增大D.重新平衡 减小
解析 该反应为正向气体分子数减小的可逆反应,缩小容器体积,平衡正向移动,c(H2)增大,正、逆反应速率均增大,因而A、B均不正确。
(2)若容器容积不变,下列措施可增大甲醇产率的是____。A.升高温度B.将CH3OH从体系中分离C.充入He,使体系总压强增大
解析 由于该反应正向是放热反应,升高温度平衡逆向移动,CH3OH的产率降低;容器容积不变,充入He,平衡不移动。
1.(2020·浙江7月选考,18)5 mL 0.1 ml·L-1 KI溶液与1 mL 0.1 ml·L-1 FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq) 2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是A.加入苯,振荡,平衡正向移动B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈红色,表明该化 学反应存在限度C.加入FeSO4固体,平衡逆向移动D.该反应的平衡常数K=
解析 加入苯,振荡,苯萃取了I2,水溶液中的c(I2)减小,平衡正向移动,A正确;反应开始时n(KI)>n(FeCl3),反应中KI过量;经苯两次萃取分离后,水溶液中c(I2)很小,加入KSCN,溶液呈红色,说明水溶液中仍含有Fe3+,证明该反应是可逆反应,存在一定限度,B正确;加入FeSO4固体,c(Fe2+)增大,平衡逆向移动,C正确;
2.(2020·浙江7月选考,20)一定条件下:2NO2(g) N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是A.温度0 ℃、压强50 kPaB.温度130 ℃、压强300 kPaC.温度25 ℃、压强100 kPaD.温度130 ℃、压强50 kPa
解析 测定NO2的相对分子质量时,要使平衡逆向移动,且逆向移动的程度越大,测定结果的误差越小。该反应的正反应是气体分子数减少的放热反应,因此温度越高、压强越小时,平衡逆向移动的程度越大,故选D。
3.(2019·海南,3)反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是A.增大容器容积 B.升高反应温度C.分离出部分氢气 D.等容下通入惰性气体
4.(2019·浙江4月选考,17)下列说法正确的是A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应 速率不变B.C(s)+H2O(g) H2(g)+CO(g),碳的质量不再改变说明反应已达平衡C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡, 则A、C不能同时是气体D.1 ml N2和3 ml H2反应达到平衡时H2转化率为10%,放出的热量为Q1; 在相同温度和压强下,当2 ml NH3分解为N2和H2的转化率为10%时, 吸收的热量为Q2,Q2不等于Q1
解析 A项,该可逆反应的反应前后气体的化学计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,错误;B项,在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,正确;C项,若压强不再改变说明反应达到平衡,表明反应前后气体的化学计量数不等,故A、C可能均为气体,错误;D项,易知N2(g)+3H2(g) 2NH3(g) ΔH,合成氨气实际参与反应n(H2)=3 ml×10%=0.3 ml,因而Q1= ×|ΔH|=0.1|ΔH|,分解氨气时实际消耗的n(NH3)=2 ml×10%=0.2 ml,Q2= ×|ΔH|=0.1|ΔH|,则Q1=Q2,错误。
5.[2018·全国卷Ⅱ,27(1)节选]CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247 kJ·ml-1,有利于提高CH4平衡转化率的条件是_____(填字母)。A.高温低压 B.低温高压C.高温高压 D.低温低压
解析 根据平衡移动的影响因素,该反应的正反应是一个吸热、气体体积增大的反应,所以高温低压有利于平衡正向移动。
①下列可判断反应达到平衡的是_____(填字母)。a.溶液的pH不再变化b.v(I-)=2v( )c.c( )不再变化d.c(I-)=y ml·L-1
②tm时,v正______(填“大于”“小于”或“等于”)v逆。③tm时v逆______(填“大于”“小于”或“等于”)tn时v逆,理由是____________________。④若平衡时溶液的pH=14,则该反应的平衡常数K为________。
1.已知可逆反应2NO2(g) N2O4(g),下列状态合理且可以判断该反应已经达到平衡的是①v正=v逆≠0的状态 ②NO2全部转化成N2O4的状态 ③c(NO2)=c(N2O4)的状态 ④N2O4不再分解的状态 ⑤NO2的百分含量不再改变的状态 ⑥体系颜色不再发生变化的状态A.①④⑥ B.①⑤⑥C.①③⑥ D.②⑤⑥
解析 ①v正=v逆≠0是化学平衡状态的本质标志,此状态合理且能说明反应已经达到平衡;②由于该反应为可逆反应,NO2不可能全部转化成N2O4,此状态不合理;③c(NO2)=c(N2O4)是一种特殊情况,但不能说明反应已经达到平衡;④化学反应达到平衡时正、逆反应仍在进行,N2O4不再分解的状态不合理;⑤NO2的百分含量不再改变的状态是化学平衡的特征标志,此状态合理且能说明反应已经达到平衡;⑥体系颜色不再发生变化的状态即NO2的浓度不再变化的状态,该状态是化学平衡的特征标志,此状态合理且能说明反应已经达到平衡;符合题意的是①⑤⑥。
2.对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知A.化学反应速率变化时,化学平衡一定发生移动B.化学平衡发生移动时,化学反应速率一定变化C.正反应进行的程度大,正反应速率一定大D.改变压强,化学反应速率一定改变,平衡一定移动
解析 如果正、逆反应速率改变的幅度一样大,则平衡不移动,A项错;化学平衡发生移动,则化学反应速率一定改变,B项对;反应进行的程度与化学反应速率无关,C项错;改变压强,化学反应速率不一定改变(如固液反应或容器容积不变的反应体系中充入不参与反应的气体),平衡也不一定移动,D错。
3.对于可逆反应2A(s)+3B(g) C(g)+2D(g) ΔHv逆⑤加入催化剂,物质B的转化率提高A.①②⑤ B.④C.②③④ D.④⑤
解析 物质A是固体,增大物质A的量对化学平衡无影响,①错误;升高温度,v正、v逆均增大,平衡向逆反应(吸热反应)方向移动,②错误;该反应为反应前后气态物质总物质的量不变的反应,增大压强平衡不移动,但v正、v逆都增大,③错误;增大物质B的浓度,正反应速率增大,v正>v逆,平衡向正反应方向移动,④正确;催化剂不能使化学平衡发生移动,故物质B的转化率不变,⑤错误。
4.下列事实不能用勒夏特列原理解释的是A.使用铁触媒,加快合成氨的反应速率B.溴水中存在Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜 色变浅C.合成氨工业采用20~50 MPa高压D.反应CO(g)+NO2(g) CO2(g)+NO(g) ΔHt2)向容器中再通入0.20 ml H2O(g),正反 应速率加快,逆反应速率减小
8.800 ℃时,向容积为2 L的密闭容器中充入一定量的 CH4和H2O,发生反应:CH4 (g)+H2O(g) CO(g)+3H2(g),t2时达到平衡状态,反应过程中测定的部分数据见表(表中时间t2>t1):
解析 A项,v(H2)= ,错误;B项,容积为2 L的密闭容器中,t2时,c(H2O)=0.30 ml·L-1,错误;C项,t2时,H2O(g)剩余0.6 ml,转化率为70.0%,正确;D项,向容器中再通入0.20 ml H2O(g),正反应速率加快,逆反应速率也增大,错误。
下列说法正确的是A.T1温度下,0~ 20 min之间,H2 的平均反应速率为0.012 5 ml·L-1·min-1B.在T1温度下,该反应有可能在70 min时已达到平衡状态C.由表中数据推测,T1>T2D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大
9.某实验小组研究温度对化学反应H2(g)+I2(g) 2HI(g)的影响,在其他条件相同时,将1 ml H2(g)和1 ml I2(g)充入体积为2 L的恒容密闭容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
解析 T1温度下,0~20 min之间,HI的物质的量分数为0.5,反应前后气体的物质的量不变,则说明生成1 ml HI,说明氢气消耗了0.5 ml,H2的平均反应速率为 =0.012 5 ml·L-1·min-1,选项A正确;由表中数据分析可知,在T1温度下,该反应70 min时没有达到平衡状态,选项B错误;T2温度下,反应更快达到平衡,其他条件不变的情况下,这是受温度影响。从而可推断T2>T1,选项C错误;T2>T1,温度越大H2(g)与I2(g)的反应限度越小,选项D错误。
10.在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH
相关课件
这是一份第26讲 化学平衡状态 化学平衡的移动-备战2024年高考化学一轮复习精品课件(全国通用),共21页。PPT课件主要包含了可逆反应,化学平衡状态,3平衡特点,2图示等内容,欢迎下载使用。
这是一份新教材适用2024版高考化学一轮总复习第7章化学反应速率与化学平衡第21讲化学平衡状态化学平衡的移动课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,保持不变,3化学平衡特征,归纳拓展,平衡状态,正反应,逆反应等内容,欢迎下载使用。
这是一份2024年高考化学一轮总复习 第6单元 第2讲 化学平衡状态 化学平衡的移动 课件,共60页。PPT课件主要包含了同一条件,保持不变,v正v逆≠0,动态平衡,保持一定,可能发生改变,①③④⑦,①③④⑤⑦,①②③④⑦,①②③等内容,欢迎下载使用。









