




- 2022怀化高一上学期期末考试政治含解析 试卷 1 次下载
- 2022怀化高一上学期期末考试地理含解析 试卷 1 次下载
- 2022怀化高一上学期期末考试历史含解析 试卷 0 次下载
- 2022怀化高一上学期期末考试生物含解析 试卷 1 次下载
- 2022怀化高一上学期期末考试物理含解析 试卷 1 次下载
2022怀化高一上学期期末考试化学含解析
展开怀化市中小学课程改革教育质量监测试卷
2021年下期期末考试高一化学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 C1-35.5
一、选择题:共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与生活、社会发展息息相关,下列说法错误的是
A. “熬胆矾铁釜,久之亦化铜”,该过程发生了置换反应
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶能产生丁达尔效应
C. “千锤万凿出深山,烈火焚烧若等闲”,石灰石煅烧成石灰发生分解反应
D. “青蒿一握,以水二升渍,绞取汁”,该过程中一定发生了化学变化
2. 下列有关的说法正确的是
A. 中子数为14 B. 质子数为8
C. 是一种核素 D. 与互为同素异形体
3. 下列化学用语表达正确的是
A. S2-离子的结构示意图:
B. 氯化钙的电子式:
C. CO2的结构式:O-C-O
D. NaHSO4在水中的电离方程式:NaHSO4=Na++
4. 下列各组物质中,化学键类型完全相同的是
A. NaCl和Na2O B. Cl2和CaCl2
C H2O2和Na2O2 D. CO2和Na2CO3
5. 同温同压下,相同体积的O2和O3具有相同的
A 密度 B. 质量 C. 分子数 D. 原子数
6. 下列物质的保存方法错误的是
A. 过氧化钠密封保存
B. 钠保存在石蜡油中
C. 漂白粉在敞口容器中长期存放
D. 新制氯水保存在棕色试剂瓶并置于冷暗处
7. 下列各组离子在水溶液中能大量共存的是
A. Na+、、Cl-、K+ B. H+、Cl-、Na+、
C. Na+、Fe3+、、OH- D. 、Na+、OH-、
8. 下列反应离子方程式书写正确的是
A. 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B. 氧化铝与NaOH溶液反应:Al2O3+2OH-=2+H2O
C. Na与水反应:Na+2H2O=Na++2OH-+H2↑
D. NaHCO3溶液与稀盐酸反应:+2H+=CO2↑+H2O
9. 下列说法正确的是
A. 0.2mol由H218O与D2O组成的体系中含有的中子数为2NA
B. 常温常压下,2.24LCl2中含有的原子数为0.2NA
C. 过氧化钠与水反应时,每生成1mol氧气转移电子数为NA
D. 0.15mol·L-1K2CO3溶液中含有的钾离子数为0.3NA
10. 有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A. A2B中只含极性共价键
B. B和C两种元素形成的化合物--定含有离子键也可能含有共价键
C. E单质可以使干燥的红色布条褪色
D. D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
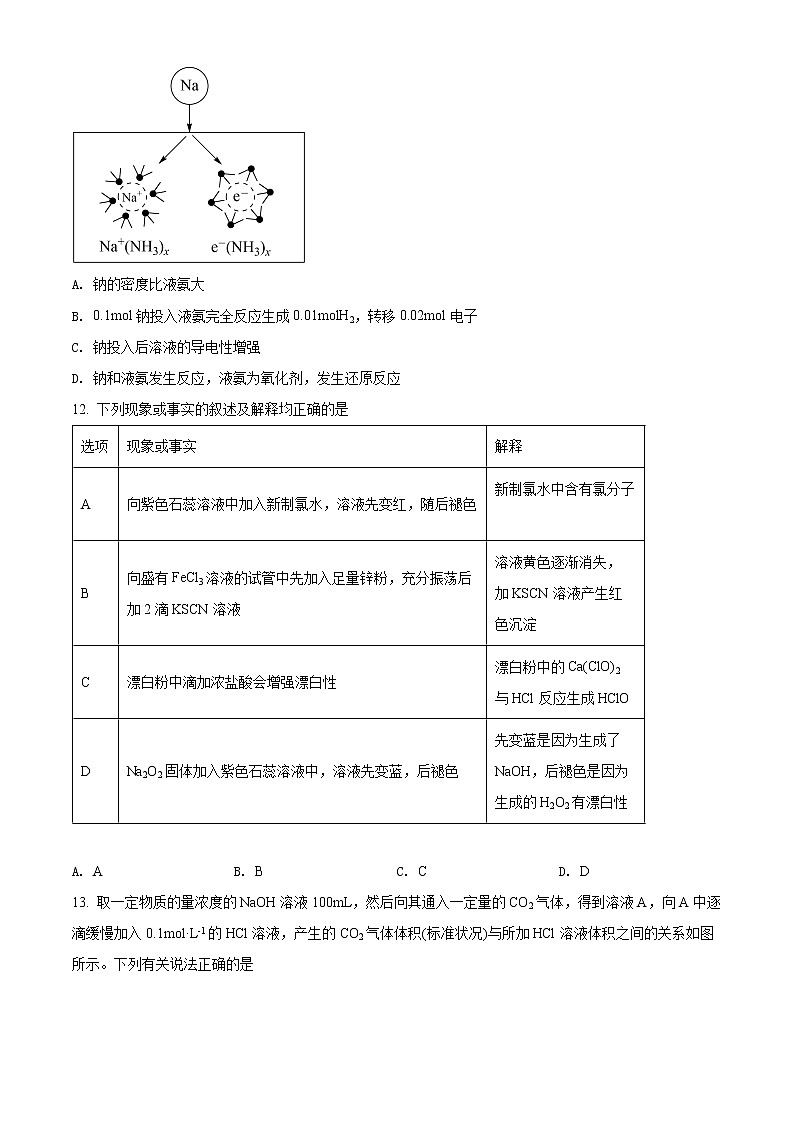
11. 钠在液氨(NH3)中溶剂化速度极快,生成蓝色的溶剂合电子,下图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡(H2)。下列说法错误的是
A. 钠的密度比液氨大
B. 0.1mol钠投入液氨完全反应生成0.01molH2,转移0.02mol电子
C. 钠投入后溶液的导电性增强
D. 钠和液氨发生反应,液氨为氧化剂,发生还原反应
12. 下列现象或事实的叙述及解释均正确的是
选项 | 现象或事实 | 解释 |
A | 向紫色石蕊溶液中加入新制氯水,溶液先变红,随后褪色 | 新制氯水中含有氯分子
|
B | 向盛有FeCl3溶液的试管中先加入足量锌粉,充分振荡后加2滴KSCN溶液 | 溶液黄色逐渐消失,加KSCN溶液产生红色沉淀 |
C | 漂白粉中滴加浓盐酸会增强漂白性 | 漂白粉中的Ca(ClO)2与HCl反应生成HClO |
D | Na2O2固体加入紫色石蕊溶液中,溶液先变蓝,后褪色 | 先变蓝是因为生成了NaOH,后褪色是因为生成的H2O2有漂白性 |
A. A B. B C. C D. D
13. 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol·L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液体积之间的关系如图所示。下列有关说法正确的是
A. A溶液中溶质为Na2CO3和NaHCO3
B. BC段对应离子方程式为OH-+H+=H2O
C. 通入CO2气体在标况下的体积为56mL
D. 原NaOH溶液物质的量浓度为0.065mol·L-1
14. 利用NaClO氧化尿素[CO(NH2)2]制备N2H4·H2O(水合肼)的实验流程如图所示:
已知:①氯气与烧碱溶液的反应是放热反应;②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。下列说法错误的是
A. 步骤I中为避免温度过高,可采用冰水浴
B. 步骤I制备NaClO溶液时,若溶液中NaClO与副产物NaClO3的物质的量之比为5:1,则参与反应的氧化剂与还原剂的物质的量之比为5:3
C. 步骤II中可将NaClO碱性溶液逐滴滴入尿素水溶液中
D. 生成水合肼反应的离子方程式为ClO-+CO(NH2)2+2H+=Cl-+N2H4·H2O+
二、非选择题:共4题,共58分
15. 按要求填空。
(1)下列物质中:①稀硫酸②液氯③熔融氯化钠④Fe⑤二氧化碳⑥乙醇⑦BaSO4,属于电解质的是______(填序号,下同);能直接导电的是______。
(2)请写出下列反应的离子方程式。
①盐酸除去铁锈(主要成分为氧化铁)______。
②溴水与NaI溶液反应______
③FeCl2溶液与新制氯水反应______。
(3)1.204×1024个H2SO4分子的质量为______ g,共含______个氢原子。
(4)工业废水中含有有毒的重铬酸根离子(),必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)还原得Cr3+和Fe3+,再通过沉淀处理法来处理该污水。写出该过程中Fe2+还原的离子方程式______。
16. 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
a |
|
|
|
|
|
|
| b |
|
|
|
| c | d | e | f |
|
g | h |
| i | j | k | l | m |
|
|
|
|
|
|
|
| n |
|
回答下列问题:
(1)j在元素周期表中的位置是______。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______。
17. 2020年全世界爆发了新冠疫情,生活中防范疫情的有效手段之一就是将接触的陌生物质进行消毒。氯气(C12)是制备消毒剂的主要原料之一,回答下列问题:.
(1)写出实验室制氯气的化学方程式______。
(2)B中盛装浓盐酸的仪器名称为______。
(3)F的作用为______。
(4)从图中选择合适装置制备并收集纯净干燥的氯气且防尾气污染(仪器不重复使用),仪器连接顺序为_______(用仪器下方字母表示,如A→B……)。
II.工业上电解饱和食盐水制取氯气
(5)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、等杂质离子,使用的试剂有:A.Na2CO3溶液;B.Ba(OH)2;溶液C.稀盐酸,其中合理的加入顺序为________(填字母序号,每种试剂只能用一次)
(6)电解饱和食盐水制氯气的同时还生成了H2和NaOH,反应的化学方程式为______。
(7)实验室欲配制4.0mol·L-1的食盐水100mL。请回答:
①需要纯净的NaCl______g。
②下列仪器在配制食盐水时不需要使用的是_______(填字母序号);缺少的仪器是______ (写名称)。
③下列操作会使所配溶液浓度偏大的是______ (填字母序号)。
A.容量瓶中原来有少量蒸馏水
B.转移完溶液后未洗涤玻璃棒和烧杯
C.定容时,俯视刻度线
D.摇匀后发现液面低于刻度线,再加水至刻度线
18. 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
已知K2FeO4的部分性质如下:
溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
稳定性 | 温度为0-5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
回答下列问题:
(1)写出①中反应的离子方程式______。
(2)②加入NaOH固体的目的是______ (填字母序号)。
A与溶液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4
C.为后续反应提供碱性环境
(3)写出④中反应的离子方程式_______;④中一般加铁的硝酸盐或硫酸盐而不用氯化物,原因是______。
(4)往溶液II中加入饱和KOH溶液,能够得到湿产品K2FeO4的原因是______。
(5)⑥中洗涤时,洗涤剂最好选用 (填字母序号)。
A. H2O B. KOH溶液 C. 异丙醇 D. FeCl2溶液
(6)该工艺流程中可循环使用的物质是______ (填化学式)。
2023怀化高二上学期期末考试化学试题含解析: 这是一份2023怀化高二上学期期末考试化学试题含解析,文件包含湖南省怀化市2022-2023学年高二上学期期末考试化学试题含解析docx、湖南省怀化市2022-2023学年高二上学期期末考试化学试题无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
2023怀化高二上学期期末考试化学试题含解析: 这是一份2023怀化高二上学期期末考试化学试题含解析,文件包含湖南省怀化市2022-2023学年高二上学期期末考试化学试题含解析docx、湖南省怀化市2022-2023学年高二上学期期末考试化学试题无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
2022蚌埠高一上学期期末考试化学含解析: 这是一份2022蚌埠高一上学期期末考试化学含解析,文件包含安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题含解析docx、安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题无答案docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。











