

- 2022年高考化学二轮复习 第2章 第12讲 专项提能特训1 从氧化还原反应的视角分析“化工生产”中的物质变化 (含解析)课件PPT 课件 0 次下载
- 2022年高考化学二轮复习 第3章 第16讲 专项提能特训2 工业流程中含铁化合物的制备 (含解析)课件PPT 课件 0 次下载
- 2022年高考化学二轮复习 第4章 第20讲 专项提能特训4 含氯化合物的制备 (含解析)课件PPT 课件 0 次下载
- 2022年高考化学二轮复习 第5章 第28讲 专项提能特训6 根据元素周期律预测物质性质 (含解析)课件PPT 课件 0 次下载
- 2022年高考化学二轮复习 第4章 第24讲 专项提能特训5 非金属及其化合物对环境的影响 (含解析)课件PPT 课件 0 次下载
2022年高考化学二轮复习 第3章 第18讲 专项提能特训3 热点金属及其化合物的制备大题 (含解析)课件PPT
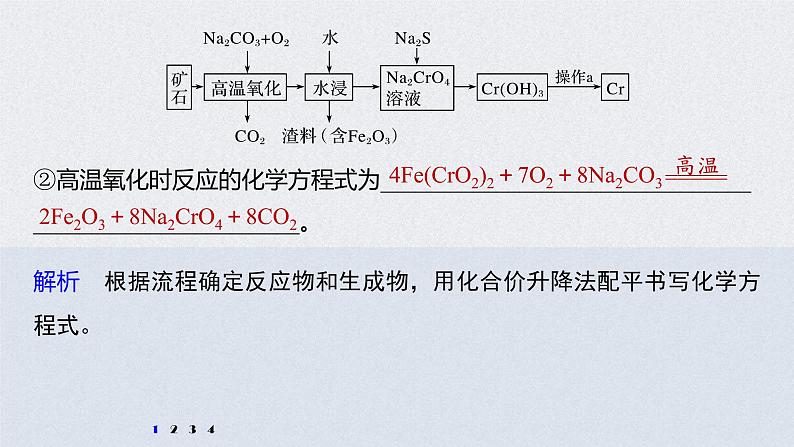
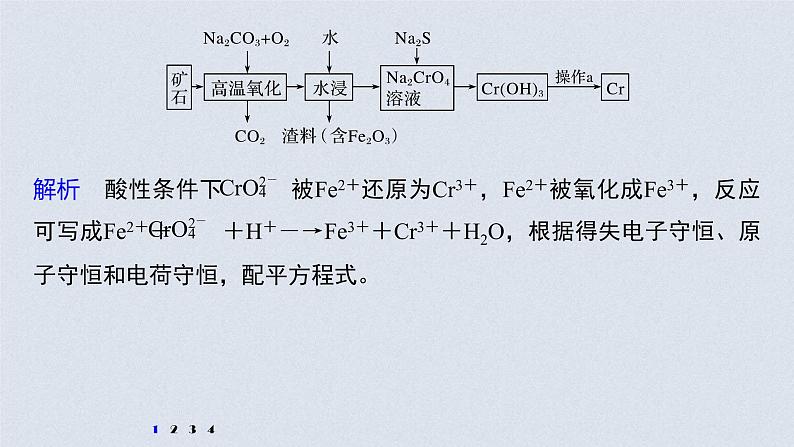
展开1.铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1 857 ℃。(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
①Fe(CrO2)2中各元素化合价均为整数,则铬为____价。
解析 根据化合物中各元素的正负化合价代数和为0分析。
②高温氧化时反应的化学方程式为_______________________________________________________。
4Fe(CrO2)2+7O2+8Na2CO3
2Fe2O3+8Na2CrO4+8CO2
解析 根据流程确定反应物和生成物,用化合价升降法配平书写化学方程式。
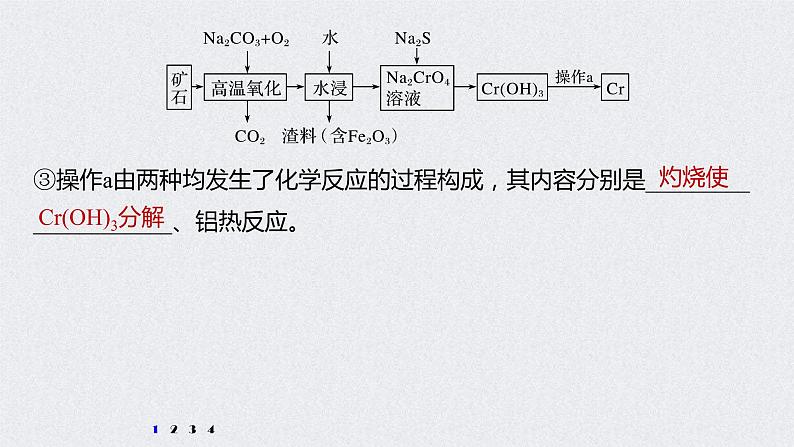
③操作a由两种均发生了化学反应的过程构成,其内容分别是_____________________、铝热反应。
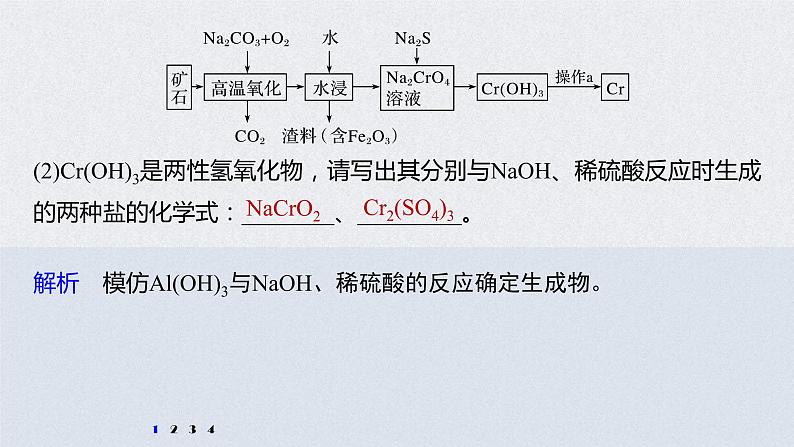
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式:________、_________。
解析 模仿Al(OH)3与NaOH、稀硫酸的反应确定生成物。
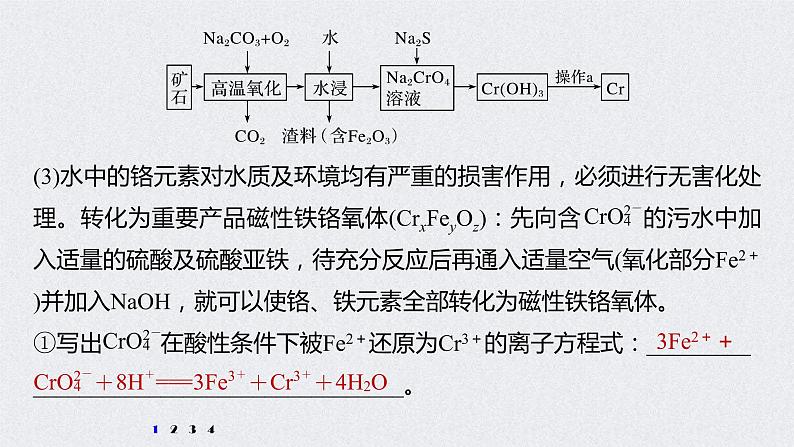
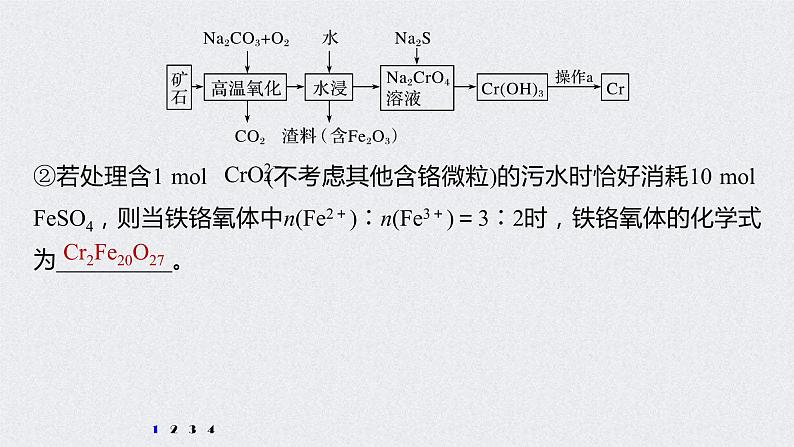
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:_________________________________________。
②若处理含1 ml (不考虑其他含铬微粒)的污水时恰好消耗10 ml FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
铁铬氧体中n(Cr)∶n(Fe)∶n(O)=1 ml∶10 ml∶13.5 ml=2∶20∶27,铁铬氧体的化学式为Cr2Fe20O27。
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。回答下列问题:(1)步骤①混合研磨成细粉的主要目的是_______________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,则其反应的化学方程式为______________________________________________________。
2.一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如图:
增大接触面积,提高硫酸浸取时
3MnO2+2FeS2+6H2SO4===3MnSO4+Fe2(SO4)3
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入_____________________;步骤④需将溶液加热至沸,然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_______________________________________________。步骤⑤所得滤渣为________(填化学式)。
破坏Fe(OH)3胶体并使沉淀颗粒长大,便于过滤
解析 由于Fe2+具有较强的还原性,在酸性条件下可用软锰矿粉(MnO2)或H2O2将其氧化为Fe3+,既不引入杂质,又能达到除去的目的;用碱液处理时,需将溶液加热至沸,然后在不断搅拌下调节pH为4~5,再继续煮沸一段时间,以破坏Fe(OH)3胶体并使沉淀颗粒增大,便于过滤分离,得到的滤渣为Fe(OH)3。
(3)步骤⑦需在90~100 ℃下进行,该反应的化学方程式为______________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c ml·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液V mL,产品中Mn2+的质量分数为w(Mn2+)=_________。
解析 已知本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。根据得失电子守恒可得二者反应的化学方程式为2KMnO4+3MnSO4·H2O===5MnO2+K2SO4+2H2SO4+H2O,已知n(KMnO4)=c ml·L-1×V×10-3L=cV×10-3ml,则n(MnSO4·H2O)=1.5cV×10-3ml,
3.(2020·日照模拟)铋(83号元素)主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为Bi2O3,含有PbO、Ag2O、CuO杂质)为原料提Bi的工艺流程如图:
已知:Ⅰ.BiOCl不溶于水,加热至700 ℃就分解生成BiCl3,BiCl3的沸点为447 ℃;Ⅱ.25 ℃时,Ksp[Cu(OH)2]=1.2×10-20;Ksp(PbCl2)=1.17×10-5。
回答下列问题:(1)“滤渣Ⅰ”的成分为____________(填化学式)。
解析 根据工艺流程图分析可知,铋渣中加入盐酸和饱和NaCl溶液,滤渣Ⅰ的成分是AgCl和PbCl2。
(2)“脱氯”的化学方程式为______________________________________。
(3)“沉铜”时,向“滤液Ⅱ”中加入NaOH溶液调节pH,促进Cu2+水解生成Cu3(OCl)2,则此过程中Cu2+水解的离子方程式为________________________________________。若“滤液Ⅱ”中c(Cu2+)为0.01 ml·L-1,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀Cu(OH)2,此时Cu2+的去除率为________(忽略溶液体积变化)。
3Cu2++2H2O+
2Cl-===Cu3(OCl)2↓+4H+
解析 “沉铜”时,向滤液Ⅱ中加入NaOH溶液调节pH,促进Cu2+水解生成Cu3(OCl)2,反应的离子方程式为3Cu2++2H2O+2Cl-===Cu3(OCl)2↓+4H+,加入等体积的NaOH溶液时,pH=6,溶液中c(H+)=10-6ml·L-1,则c(OH-)=10-8ml·L-1,由于Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-),则c(Cu2+)=0.000 12 ml·L-1,n(Cu2+)=0.000 12 ml·L-1×2V L=0.000 24V ml,则去除的Cu2+的物质的量为0.01V ml-0.000 24V ml=0.009 76V ml,
(4)“滤液Ⅲ”经加热浓缩后可返回_____工序循环使用。
解析 滤液Ⅲ为NaCl溶液,经加热浓缩后可返回浸出工序循环使用。
4.(2020·山东新高考5月模拟)利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如图,回答下列问题:
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。② +4H+===Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式:_______________________________________;废渣Ⅰ的主要成分是_______;精制Ⅰ中加盐酸调pH的主要作用是_________________________,加入NH3·H2O后发生反应的离子方程式为______________________________________________________________。
4FeO·V2O3+5O2
经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3成为滤渣;
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________________________________________________________________;pH过大时,沉淀量增大的原因是__________________。
的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙)
产生了Ca(OH)2沉淀
解析 精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时易形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀。
+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为______________________________________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是_____。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应的化学方程式为2NH4VO3 V2O5+H2O↑
2022年高考化学二轮复习 第8章 第39讲 专项提能特训15 滴定过程的曲线分析 (含解析)课件PPT: 这是一份2022年高考化学二轮复习 第8章 第39讲 专项提能特训15 滴定过程的曲线分析 (含解析)课件PPT,共26页。PPT课件主要包含了c点以上等内容,欢迎下载使用。
2022年高考化学二轮复习 第7章 第35讲 专项提能特训13 多平衡体系的综合分析 (含解析)课件PPT: 这是一份2022年高考化学二轮复习 第7章 第35讲 专项提能特训13 多平衡体系的综合分析 (含解析)课件PPT,共23页。PPT课件主要包含了该反应为放热反等内容,欢迎下载使用。
2022年高考化学二轮复习 第6章 第30讲 专项提能特训10 新型电源工作原理 (含解析)课件PPT: 这是一份2022年高考化学二轮复习 第6章 第30讲 专项提能特训10 新型电源工作原理 (含解析)课件PPT,共36页。PPT课件主要包含了从A到B等内容,欢迎下载使用。












