
2021-2022学年北京市西城区高三(上)期末化学试卷( 含答案解析)
展开
这是一份2021-2022学年北京市西城区高三(上)期末化学试卷( 含答案解析),共21页。试卷主要包含了4kJ/ml,2kJ/ml,6kJ/ml,【答案】C,【答案】A,【答案】B等内容,欢迎下载使用。
科技助力北京2022年冬奥会。下列变化不属于化学变化的是( )
A. AB. BC. CD. D
下列物质的应用中,与氧化还原反应无关的是( )
A. 用含Fe2O3的铁矿石冶炼FeB. 用Na2O2作潜水艇的供氧剂
C. 用NaOH作沉淀剂去除粗盐水中的Mg2+D. 以NH3为原料制备HNO3
下列比较正确的是( )
A. 第一电离能:Be>BB. 热稳定性:H2S>H2O
C. 碱性:Al(OH)3>Mg(OH)2D. 原子半径:N>C
下列化学用语或图示表达正确的是( )
A. CO2分子的结构模型:
B. 基态Cr的电子排布式:1s22s22p63s23p63d44s2
C. 基态磷原子的轨道表示式:
D. 原子核内中子数为20的氯原子: 1720Cl
我国科学家从中国特有的喜树中分离得到具有肿瘤抑制作用的喜树碱,结构如图。下列关于喜树碱的说法不正确的是( )
A. 能发生加成反应
B. 不能与NaOH溶液反应
C. 羟基中O−H的极性强于乙基中C−H的极性
D. 带*的氮原子有孤电子对,能与含空轨道的H+以配位键结合
能用如图所示装置完成气体制备、尾气处理(加热和夹持等装置略去)的是( )
A. A
B. B
C. C
D. D
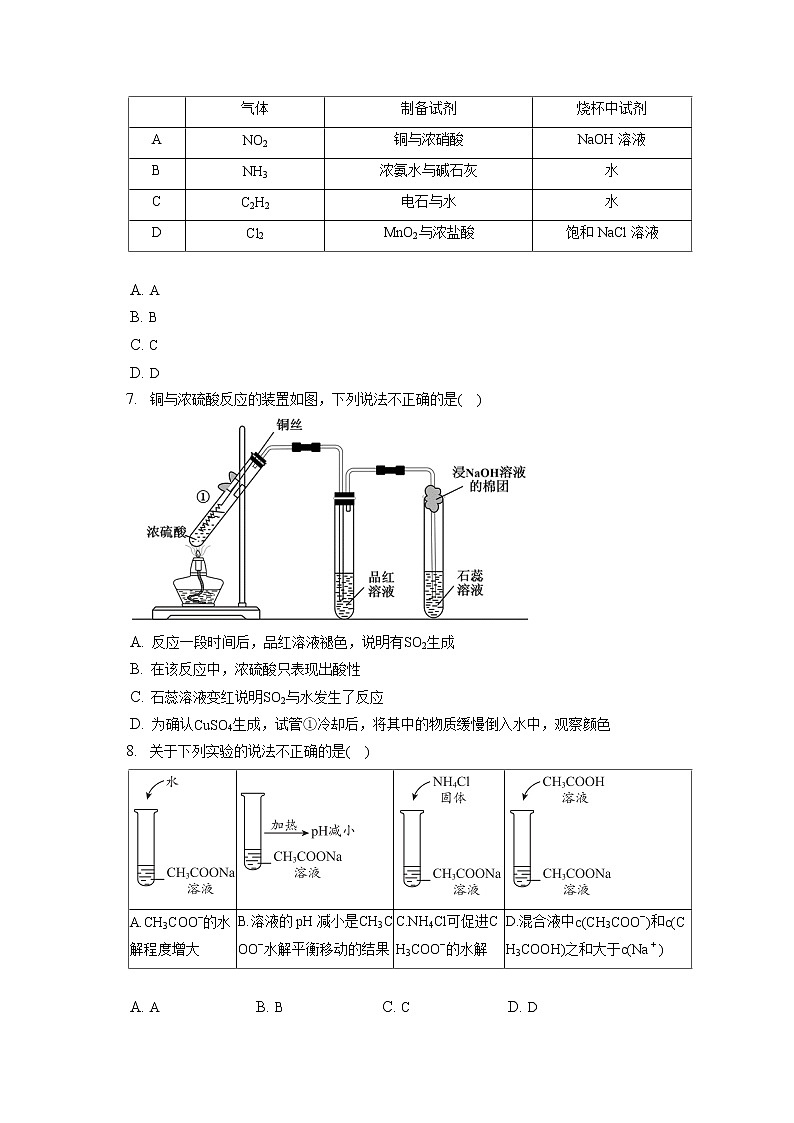
铜与浓硫酸反应的装置如图,下列说法不正确的是( )
A. 反应一段时间后,品红溶液褪色,说明有SO2生成
B. 在该反应中,浓硫酸只表现出酸性
C. 石蕊溶液变红说明SO2与水发生了反应
D. 为确认CuSO4生成,试管①冷却后,将其中的物质缓慢倒入水中,观察颜色
关于下列实验的说法不正确的是( )
A. AB. BC. CD. D
下列方程式不能准确解释相应实验现象的是( )
A. 向AlCl3溶液中滴入氨水产生白色沉淀:Al3++3NH3⋅H2O=Al(OH)3↓+3NH4+
B. 红棕色的NO2溶于水变为无色:3NO2+H2O=2HNO3+NO
C. 红热的Fe粉和水蒸气反应生成黑色固体:2Fe+3H2OFe2O3+3H2
D. 向AgCl悬浊液中滴加KI溶液产生黄色沉淀:AgCl(s)+I−(aq)⇌AgI(s)+Cl−(aq)
高分子P1通过加入化合物B可得高分子P2。其合成路线如图:
已知:
下列说法正确的是( )
A. 有机物A存在顺反异构B. 有机物A与乙烯互为同系物
C. 反应①为加成聚合反应D. P2只能是线型结构的高分子
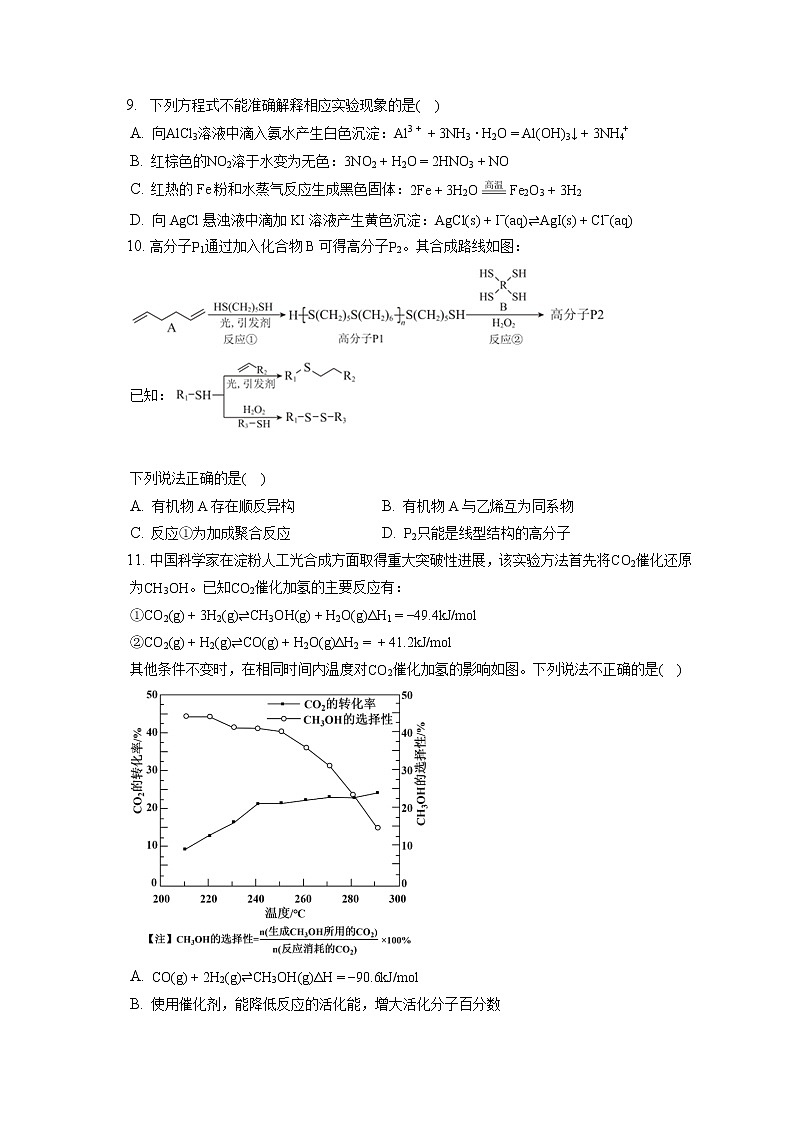
中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=−49.4kJ/ml
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ/ml
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是( )
A. CO(g)+2H2(g)⇌CH3OH(g)ΔH=−90.6kJ/ml
B. 使用催化剂,能降低反应的活化能,增大活化分子百分数
C. 其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行
D. 220∼240℃,升高温度,对反应②速率的影响比对反应①的小
采用如图装置制备乙烯并研究乙烯与溴水的反应。实验观察到溴水褪色,得到无色透明的溶液。进一步分析发现反应产物主要为BrCH2CH2OH,含少量BrCH2CH2Br。下列说法不正确的是( )
A. 实验室制乙烯的方程式:CH3CH2OH→170℃浓硫酸CH2=CH2↑+H2O
B. 除杂试剂A为NaOH溶液
C. 乙烯与溴水反应后的溶液近乎中性
D. BrCH2CH2OH与H2O之间存在氢键
微生物电池可用来处理废水中的对氯苯酚,其工作原理示意图如图。关于该电池的说法不正确的是( )
A. a极是负极
B. H+向b极迁移
C. 对氯苯酚在电极上发生的反应是+H++2e−=+Cl−
D. 电路中通过0.4mle−,消耗了0.1mlCH3COO−
研究小组为探究Na2S晶体在空气中变质后的产物,进行实验并记录现象如下:
①取Na2S样品加水溶解,得到澄清溶液a。
②取少量溶液a加入过量盐酸,有臭鸡蛋气味的气体放出,且出现淡黄色浑浊。
③将②中浊液过滤,向滤液中加入BaCl2溶液,产生白色沉淀。
资料:
i.Na2S溶液能溶解S生成Na2Sx,Na2Sx与酸反应生成S和H2S(臭鸡蛋气味)
ii.BaS易溶于水
下列说法不正确的是( )
A. ②中淡黄色浑浊可能是Sx2−与H+反应产生的
B. ①和②说明该Na2S样品中含有S
C. ③中白色沉淀是BaSO4
D. 该Na2S样品中可能含有Na2SO3
硅烷SiH4可用于制造高纯硅。采用硅化镁法制备SiH4的化学方程式如下:Mg2Si+4NH4Cl+8NH3=SiH4+2MgCl2⋅6NH3
(1)硅在元素周期表中的位置是 ______,基态硅原子占据的最高能级的符号是 ______。
(2)①SiH4的电子式是 ______。
②SiH4的沸点比CH4的 ______。(填“高”或“低”),原因是 ______。
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于 ______晶体(填晶体类型),一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如图1)。其中Si原子的杂化轨道类型是 ______。
(4)Mg2Si晶体的晶胞示意图如图2。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有 ______个紧邻的Mg原子。已知Mg2Si的晶胞边长为acm,阿伏加德罗常数的值为NA,则Mg2Si晶体的密度为 ______g⋅cm−3。
工业上利用生产磷肥的副产品高磷镍铁制备硫酸镍晶体NiSO4⋅6H2O。
(1)制备含Ni2+溶液
高磷镍铁→转炉吹炼镍铁合金→电解造液含Ni2+溶液
已知:i.高磷镍铁和镍铁合金中元素的百分含量:
ii.金属活动性:Fe>C>Ni>H
①依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分 ______。
②“电解造液”时,用镍铁合金作阳极,H2SO4溶液作电解质溶液。电解过程中阴极产生的气体是 ______。电解一段时间后,有少量Ni在阴极析出,为防止Ni析出降低NiSO4⋅6H2O的产率,可向电解质溶液中加入 ______(填试剂)。
(2)制备NiSO4⋅6H2O
已知:常温下,金属离子完全转化为氢氧化物沉淀的pH:
①在酸性条件下,NaClO和Fe2+反应生成Fe3+和Cl−的离子方程式是 ______。
②已知Ni(OH)2的Ksp为5.48×10−16,滤液1中c(Ni2+)=1.37ml/L。结合数据说明不能通过调节溶液的pH除去Cu2+的原因:______。(已知:lg5=0.7)
③从滤液3中获取NiSO4⋅6H2O的操作是 ______、洗涤、干燥。
我国科学家合成了结构新颖的化合物M,为液晶的发展指明了一个新的方向。M的合成路线如图:
资料i.+−NH2→HCOOHC2H5OH+H2O
(1)A是苯的同系物,苯环上只有一种环境的氢原子。A的结构简式是 ______。
(2)B的官能团的名称是 ______。
(3)B→D的反应类型是 ______。
(4)J的结构简式是 ______。
(5)下列有关K的说法正确的是 ______(填序号)。
a.与FeCl3溶液作用显紫色
b.含有醛基、羟基和醚键
c.存在含有苯环和碳碳双键的酯类同分异构体
(6)E与K生成L的化学方程式是 ______。
(7)依据资料i和资料ii,某小组完成了尼龙6的合成设计。
资料ii.→H+
P、Q的分子式都是C6H11ON,Q含有1个七元环。P的结构简式是 ______,生成尼龙6的化学方程式是 ______。
某小组欲用电解的方法获得Cu(OH)2,实验装置如图(电源装置略去)。
(1)分别以NaOH溶液和NaCl溶液为电解质溶液制备Cu(OH)2。
资料:i.CuOH是黄色、易分解的难溶固体,CuCl是白色的难溶固体。
ii.氧化反应中,增大反应物浓度或降低生成物浓度,氧化反应越易发生
①I和II中Cu作 ______极(填“阳”或“阴”)。
②II中石墨电极产生气体的电极反应式为 ______。
③II中白色沉淀变为砖红色的离子方程式是 ______。根据II中现象,甲认为电解质溶液中存在Cl−,有利于Cu被氧化为一价铜化合物,理由是 ______。
(2)探究I和II中未生成Cu(OH)2的原因,继续实验。
资料:碱式硫酸铜[xCu(OH)2⋅yCuSO4]难溶于水,可溶于酸和氨水。常温时碱式硫酸铜[xCu(OH)2⋅yCuSO4]的溶解度比Cu(OH)2的大
①经检验,蓝绿色沉淀中含有碱式硫酸铜,检验方案是 ______。
②小组认为适当增大c(OH−)可以减少碱式硫酸铜的生成,理由是 ______。
(3)进一步改进方案,进行如下实验。
IV中出现深蓝色说明电解生成了 ______离子。经检验,V中最终生成了Cu(OH)2。
(4)综合上述实验,电解法制备Cu(OH)2要考虑的因素有 ______。
某小组为测定I−(aq)+I2(aq)⇌I3−(aq)的平衡常数,完成实验I和实验II。
已知:i.2Na2S2O3+I2=Na2S4O6+2NaI
ii.I−与I3−难溶于CCl4
iii.室温下,达到溶解平衡后,I2在CCl4层和水层中的分配比c(I2)CCl4c(I2)H2O为常数
实验I:测定分配比
(1)在2Na2S2O3+I2=Na2S4O6+2NaI中,I2作 ______剂(填“氧化”或“还原”)。
(2)I2易溶于CCl4的原因是 ______,分液操作用到的主要玻璃仪器有 ______、烧杯。
(3)滴定时选用的指示剂是 ______,滴定终点的现象是 ______。
(4)实验测得分配比为86:1,则V1:V2=______。
实验II:测定平衡常数
(5)通过V4可推知水层2中I2和I3−的总浓度,结合平衡移动原理解释原因:______。
(6)通过实验I和实验II,测得平衡常数K=______(用含c、V3、V4的代数式表示,可以不化简)。
答案和解析
1.【答案】A
【解析】A.冬奥场馆使用CO2制冷剂制冰,利用固体二氧化碳升华吸收热量,过程中无新物质生成,为物理变化,故A正确;
B.火炬“飞扬”中的氢燃料燃烧发生了化学反应,为化学变化,故B错误;
C.由碲和镉合成发电玻璃中的碲化镉,发生了化学反应,为化学变化,故C错误;
D.电动汽车的全气候电池充电,是电解过程,发生了化学反应,故D错误;
故选:A。
物质变化过程中生成新物质的变化为化学变化,无新物质生成的变化为物理变化。
本题考查了物质变化的分析判断,注意变化实质的理解应用,题目难度不大。
2.【答案】C
【解析】A.用含Fe2O3的铁矿石冶炼Fe,Fe化合价发生变化,与氧化还原反应有关,故A不选;
B.Na2O2作潜水艇的供氧剂,过氧化钠中O元素化合价发生变化,与氧化还原反应有关,故B不选;
C.用NaOH作沉淀剂去除粗盐水中的Mg2+,化合价不发生变化,与氧化还原反应无关,故C选;
D.以NH3为原料制备HNO3,N的化合价发生变化,存在元素化合价的变化,涉及氧化还原反应,故D不选;
故选:C。
本题考查氧化还原反应的应用,为高频考点,把握发生反应实质为解答关键,注意掌握氧化还原反应概念及特征,试题侧重考查学生的分析与应用能力,题目难度不大。
3.【答案】A
【解析】A.Be的2s轨道处于全满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:Be>B,故A正确;
B.非金属性S
相关试卷
这是一份2019北京市西城区高二(上)期末化学含答案,共11页。试卷主要包含了8 kJ热量,6 kJ·ml−1,,5的溶液,3 kJ·ml−1等内容,欢迎下载使用。
这是一份2021-2022学年北京市房山区高三(上)期末化学试卷( 含答案解析),共23页。试卷主要包含了204×1024,【答案】D,【答案】A,【答案】C等内容,欢迎下载使用。
这是一份2021-2022学年北京市东城区高三(上)期末化学试卷( 含答案解析),共21页。试卷主要包含了Ea2,且Ea1>Ea2等内容,欢迎下载使用。









