






所属成套资源:(通用版)高考化学一轮复习考点课件 (含解析)
(通用版)高考化学一轮复习课件第四章非金属及其化合物第2节考点3卤素的性质及X-的检验 (含解析)
展开
这是一份(通用版)高考化学一轮复习课件第四章非金属及其化合物第2节考点3卤素的性质及X-的检验 (含解析),共25页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,淡黄色,Br-,思维深化,考点突破等内容,欢迎下载使用。
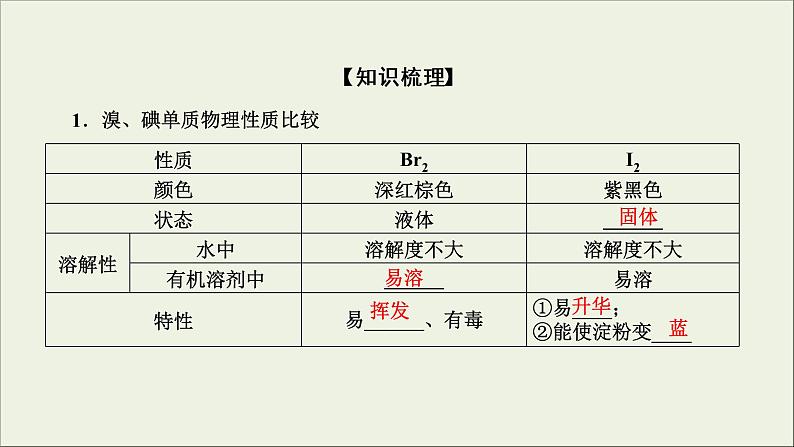
1.溴、碘单质物理性质比较
2.氯、溴、碘单质化学性质比较(1)与碱溶液反应。如与NaOH溶液反应的化学方程式为_____________________________________(X=Cl、Br、I)。(2)氧化性。①都能与金属反应生成金属卤化物,如与钠反应的化学方程式为______________________(X=Cl、Br、I)。
2NaOH+X2===NaX+NaXO+H2O
2Na+X2===2NaX
Br2+2I-===2Br-+I2
3.卤素单质性质的特殊性(1)Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封来保存。(2)I2易升华,I2遇淀粉变_______。(3)Br2和I2都可被某些有机溶剂(如四氯化碳、苯)萃取。(4)氟元素无正价,F2与H2O发生置换反应生成O2:2F2+2H2O===4HF+O2。
1.判断正误(正确的画“√”,错误的画“×”)。(1)海水提溴的过程中不发生氧化还原反应( )(2)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色( )(3)碘易升华,可用加热升华法除去NH4Cl中混有的I2( )(4)实验室保存少量液溴时常加少量水液封,并用玻璃塞密封,不能用橡胶塞( )(5)类比Fe与Cl2反应,可知Fe与I2反应产物为FeI3( )
(12)某溶液加入氯水后振荡,再加入CCl4振荡,下层显示紫色,说明原溶液中一定含有I-( )(13)某溶液中滴加AgNO3溶液和稀硝酸,产生淡黄色沉淀,说明原溶液中一定含有Br-( )(14)I-遇淀粉变蓝色( )【答案】(1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)× (9)√ (10)× (11)√ (12)× (13)√ (14)×
2.下列事实或实验的结论正确的是________(填序号)。①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI-淀粉溶液中,溶液变蓝,说明氧化性:Cl2>Br2>I2②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难,说明氧化性:Cl2>Br2>I2③Fe分别与Cl2、Br2、I2反应生成的化合物中铁的化合价,说明氧化性:Cl2>Br2>I2④HCl、HBr、HI的热稳定性越来越差,说明氧化性:Cl2>Br2>I2
⑤Cl2、Br2、I2在水中的溶解度逐渐减小,说明氧化性:Cl2>Br2>I2⑥向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,现象是溶液变成蓝色,说明氧化性:Cl2>I2⑦向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,说明Br-还原性强于Cl-【答案】①②④⑥⑦
1.(2018·广东深圳中学月考)下列有关卤素的说法错误的是( )A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度【答案】A
卤素的性质及递变规律★★★★
2.下图是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )A.单质①是最活泼的非金属单质B.单质②能使品红溶液褪色C.保存单质③时加少量水进行水封D.单质的氧化性是④>③>②>①【答案】D
【解析】从图中可以看出,从F2~I2,相对分子质量增大,沸点也依次升高,故①为F2,②为Cl2,③为Br2,④为I2,单质的氧化性是①>②>③>④,D项错误。
3.已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
【答案】A【解析】由①处产生的Cl2通过②时发生反应2NaBr+Cl2===2NaCl+Br2,通过③时发生反应Cl2+2KI===2KCl+I2,通过④时发生反应Cl2+2NaOH===NaCl+NaClO+H2O,因Cl2为黄绿色,Br2为橙色,淀粉遇I2变蓝,Cl2遇碱产生NaCl、NaClO,④处生成物无色,但棉球是白色的。
4.下列叙述正确的是( )A.能使润湿的KI-淀粉试纸变成蓝色的物质一定是Cl2B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色【答案】B【解析】还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A项错误;I-是无色的,C项错误;CCl4的密度比水大,应在下层显橙红色,D项错误。
卤素单质氧化性强弱的实验探究方法★★★★
5.下列能够检验出KI中是否含有Br-的实验是( )A.加入足量的新制氯水,溶液变色则有Br-B.加入酸性KMnO4溶液,观察溶液颜色是否褪去C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-D.加入足量H2O2溶液,用CCl4萃取后,取无色水层并加入AgNO3溶液,有淡黄色沉淀生成,则含有Br-【答案】D【解析】A项,在KI中加入足量新制氯水,也会置换出单质碘而使溶液变色,故不能确定是否含有溴离子;B项,溴离子和碘离子均能使酸性高锰酸钾溶液褪色;C项,加入少量的碘水,再加入CCl4振荡,有机层可能是萃取单质碘而显色,并没有溴单质产生。
6.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……(1)A中产生黄绿色气体,其电子式是____________。(2)验证氯气的氧化性强于碘的实验现象是______________________________。(3)B中溶液发生反应的离子方程式是___________________________________。
相关课件
这是一份2020版高考化学一轮复习考点备考课件4.2.3卤素的来源及性质 (含解析),共9页。PPT课件主要包含了速查速测,CCl4层紫红色,FeI2,不反应不能检验,典例剖析,无加热装置,NaOH溶液,反思归纳,卤素单质性质的特殊性,试题备选等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第十章化学实验基础第2节考点3物质的检验 (含解析),共25页。PPT课件主要包含了考点3物质的检验,栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第四章非金属及其化合物第2节考点1氯的单质及其重要化合物的性质 (含解析),共34页。PPT课件主要包含了考纲解读,栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。








