




所属成套资源:(通用版)高考化学一轮复习考点课件 (含解析)
(通用版)高考化学一轮复习课件第十一章物质结构与性质第2节考点2分子的立体结构 (含解析)
展开
这是一份(通用版)高考化学一轮复习课件第十一章物质结构与性质第2节考点2分子的立体结构 (含解析),共27页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,中心原子,配位原子,配位体,配位数,考点突破等内容,欢迎下载使用。
考点2 分子的立体结构
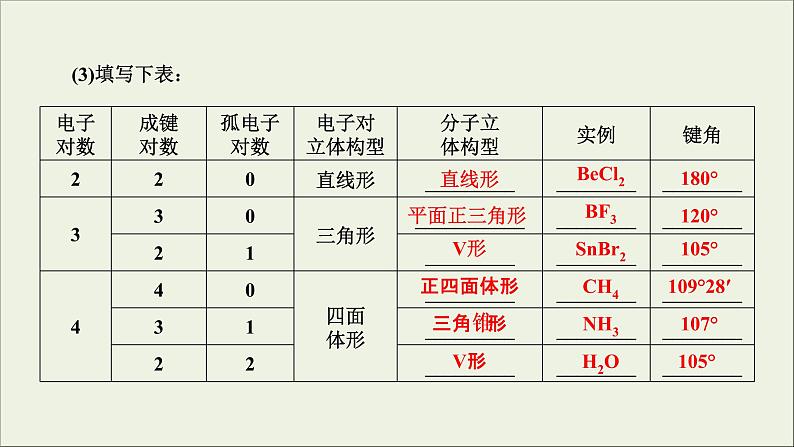
1.价层电子对互斥理论(1)价层电子对在球面上彼此相距最远时,排斥力最小,体系的能量最低。(2)孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
2.杂化轨道理论当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(3)配合物。如[Cu(NH3)4]SO4:配位体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等;中心原子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
1.(2017·山东莱芜质检)用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。下列判断正确的是( )A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°,SnBr2键角大于120°C.CH2O、BF3、SO3都是平面三角形的分子D.PCl3、NH3、PCl5都是三角锥形的分子【答案】C
价层电子对互斥理论及其应用★★★★
【解析】SO2是V形分子;CS2、HI是直线形分子,A项错误。BF3键角为120°,是平面三角形结构;而Sn原子价电子是4个,在SnBr2中2个价电子与Br形成共价键,还有一对孤对电子,对成键电子有排斥作用,使键角小于120°,B项错误。CH2O、BF3、SO3都是平面三角形的分子,C项正确。PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形结构,D项错误。
2.(1)(2018·高考信息卷)单质硫与熟石灰加热产物之一为CaS3,S的几何形状是_________,中心原子杂化方式是________。(2)(2018·荆门、荆州、襄、宜四地七校联考)配合物[Cu (CH3CN) 4] BF4[四氟硼酸四(乙腈)合铜(Ⅰ)]是有机合成中常见催化剂。该配合物中阴离子的空间构型为____________。配体分子中与Cu(Ⅰ) 形成配位键的原子为____________;配体CH3CN 中,碳原子杂化方式是________。【答案】(1)V形 sp3 (2)正四面体 N sp、sp3
判断分子或离子立体构型“三步曲”第一步:确定中心原子上的价层电子对数。
第二步:确定价层电子对的立体构型。由于价层电子对之间的相互排斥作用,它们趋向于尽可能地相互远离,这样已知价层电子对的数目,就可以确定它们的立体构型。第三步:分子立体构型的确定。价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数,得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子立体构型。
杂化轨道理论及其应用★★★★
【答案】(1)V形、sp3 直线形、sp 三角锥形、sp3 三角锥形、sp3 平面三角形、sp2 直线形、sp 平面三角形、sp2 V形、sp2 正四面体形、sp3(2)正四面体形、sp3 V形、sp2 正四面体形、sp3 三角锥形、sp3 三角锥形、sp3 正四面体形、sp3 平面三角形、sp2
4.下列关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合形成C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键【答案】C
【解析】A项,中心原子采取sp3杂化轨道成键的分子,其几何构型不都是正四面体,例如氨气是三角锥形的,错误。B项,甲烷分子碳原子的2s和2p通过sp3杂化,形成4个杂化轨道,和4个氢原子的1s轨道形成4个C—H单键,错误。C项,sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道,它们的能量完全相同,是能量等同的轨道,正确。D项,AB3型的共价化合物,其中心原子A不都采用sp3杂化轨道成键,例如BF3中的B原子是sp2杂化,是平面三角形结构,错误。
“五种”方法判断分子中心原子的杂化类型(1)根据杂化轨道的空间分布构型判断。①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化。②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化。③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。(2)根据杂化轨道之间的夹角判断。若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
配合物理论及其应用★★★
Ⅱ.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。回答下列问题:(1)往CuSO4溶液中加入过量氨水,可以生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________________________________________________。(2)向CuSO4溶液中加入过量NaOH溶液可以生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_____________________________。
(3)胆矾CuSO4·5H2O可写作[Cu(H2O)4]SO4·H2O,其结构示意图如下:
下列有关胆矾的说法正确的是______________。A.所有氧原子都采取sp3杂化B.氧原子存在配位键和氢键两种化学键C.Cu2+的价电子排布式为3d84s1D.胆矾中的水在不同温度下会分步失去
Ⅲ.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3 的个数比配合,还能以其他个数比配合。请按要求填空:(1)若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显血红色。该离子的离子符号是______________。(2)若Fe3+与SCN-以个数比1∶5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为__________________。
相关课件
这是一份(通用版)高考化学一轮复习课件第十一章物质结构与性第3节考点2常见晶体类型的结构和性质 (含解析),共21页。PPT课件主要包含了栏目导航,夯实考点,四类晶体的比较,知识梳理,阳离子,分子间作用力,共价键,金属键,离子键,典型晶体模型等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第十一章物质结构与性质第1节考点2原子结构与元素性质 (含解析),共26页。PPT课件主要包含了夯实考点,知识梳理,考点突破等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第十一章物质结构与性质第2节考点1共价键 (含解析),共21页。PPT课件主要包含了考点1共价键,栏目导航,夯实考点,知识梳理,考点突破等内容,欢迎下载使用。









