






(通用版)高考化学一轮复习课件第十一章物质结构与性质第1节考点1原子核外电子排布原理 (含解析)
展开考点1 原子核外电子排布原理
1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的____________是不同的,按照电子的____________差异将其分成不同能层。通常用K、L、M、N…表示,能量依次升高。(2)能级:同一能层里的电子的_________也可能不同,又将其分成不同的能级,通常用______________等表示,同一能层里,各能级的能量按______________等的顺序升高。
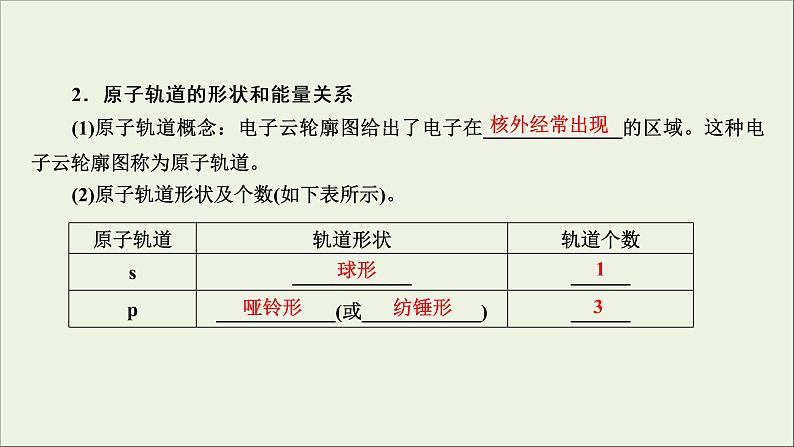
2.原子轨道的形状和能量关系(1)原子轨道概念:电子云轮廓图给出了电子在______________的区域。这种电子云轮廓图称为原子轨道。(2)原子轨道形状及个数(如下表所示)。
(3)能量关系。①相同能层上原子轨道能量的高低:ns
②泡利原理:1个原子轨道里最多只能容纳___个电子,而且自旋方向______。③洪特规则:电子排布在同一能级的不同轨道时,基态原子中的电子总是优先____________________,而且自旋方向________。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如24Cr的电子排布式为_____________________。
1s22s22p63s23p63d54s1
(2)核外电子排布表示方法。①电子排布式:按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例。如Cu:__________________________。②简化电子排布式:“[稀有气体]+价层电子”的形式表示。如Zn:_______。③价电子排布式:如Fe原子的电子排布式为__________________________,价电子排布式为______________。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
1s22s22p63s23p63d104s1
[Ar]3d104s2
1s22s22p63s23p63d64s2
4.基态、激发态与光谱(1)基态原子:电子排布遵循构造原理处于____________的原子。(2)激发态原子:当基态原子的电子______________后,电子会跃迁到较高能级,变成激发态原子。(3)原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。在日常生活中,我们看到的许多可见光,如灯光、霓虹灯光、激光、焰火等都与原子核外电子发生跃迁释放能量有关。
1.(1)(2018·广东七校联考)Zn2+在基态时核外电子排布式为__________。(2)(2018·福建龙岩质检)基态钒的原子结构示意图为____________________。(3)(2018·河北石家庄二模)基态镁原子核外电子的轨道表达式为___________,其核外有____________种能量不同的电子。(4)(2018·四川内江一模)基态K原子核外电子排布简写式为____________。K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是______________,各元素的第一电离能由大到小的顺序为______________。
微粒核外电子排布★★★★★
新高考化学一轮复习课件 第5章 第26讲 原子结构 核外电子排布原理: 这是一份新高考化学一轮复习课件 第5章 第26讲 原子结构 核外电子排布原理,共60页。PPT课件主要包含了高考化学一轮复习策略,真题演练明确考向,课时精练等内容,欢迎下载使用。
2020版高考化学一轮复习考点备考课件11.1.1原子核外电子排布原理 (含解析): 这是一份2020版高考化学一轮复习考点备考课件11.1.1原子核外电子排布原理 (含解析),共7页。PPT课件主要包含了速查速测,具体要看哪个电子层,P有3个轨道,相同都有3个轨道,d54s1,典例剖析,两个电子跃迁,号元素,反思归纳,②不符合洪特规则等内容,欢迎下载使用。
(通用版)高考化学一轮复习课件第十一章物质结构与性质第1节考点2原子结构与元素性质 (含解析): 这是一份(通用版)高考化学一轮复习课件第十一章物质结构与性质第1节考点2原子结构与元素性质 (含解析),共26页。PPT课件主要包含了夯实考点,知识梳理,考点突破等内容,欢迎下载使用。












