





所属成套资源:(通用版)高考化学一轮复习考点课件 (含解析)
(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第1节考点2化学反应速率的影响因素 (含解析)
展开
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第1节考点2化学反应速率的影响因素 (含解析),共34页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。
考点2 化学反应速率的影响因素
1.内因(主要因素)反应物本身的性质是主要因素。如相同条件下Mg、Al与稀盐酸反应的速率大小关系为__________。
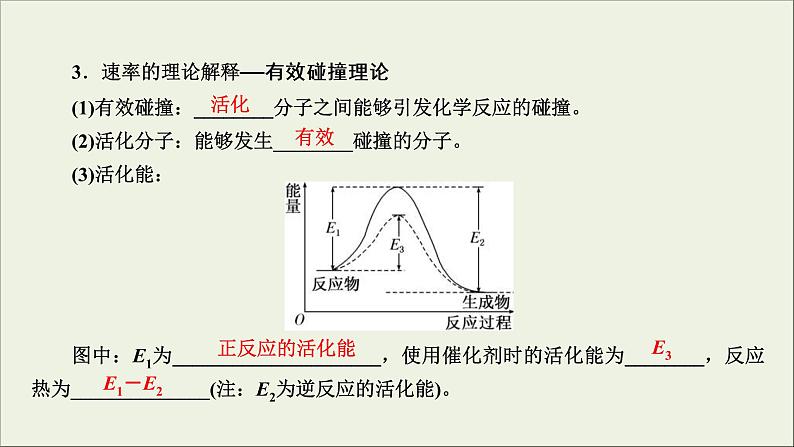
3.速率的理论解释——有效碰撞理论(1)有效碰撞:________分子之间能够引发化学反应的碰撞。(2)活化分子:能够发生________碰撞的分子。(3)活化能:图中:E1为_____________________,使用催化剂时的活化能为________,反应热为______________(注:E2为逆反应的活化能)。
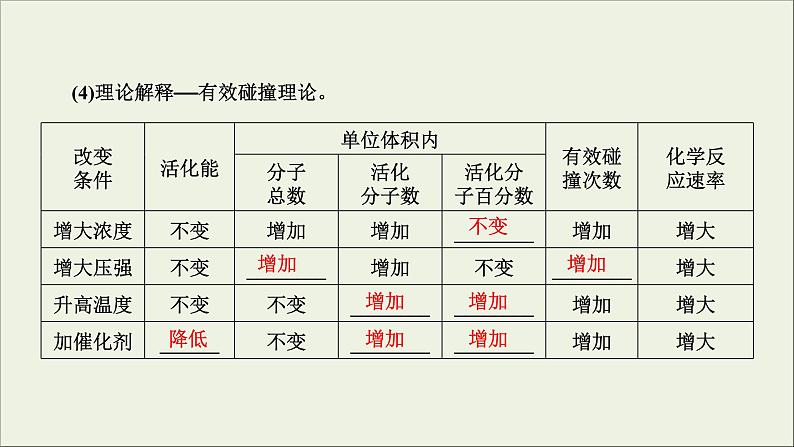
(4)理论解释——有效碰撞理论。
1.判断正误(正确的画“√”,错误的画“×”)。(1)对于反应:2H2O2===2H2O+O2↑,加入MnO2或降低温度都能加快O2的生成速率( )(2)催化剂不能参与化学反应,但可以改变反应到达平衡的时间( )(3)其他条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大( )(4)在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率( )
(5)两试管各加入5 mL 0.1 ml·L-1 Na2S2O3溶液,同时分别滴入55 mL 0.1 ml·L-1硫酸和盐酸,两支试管同时变浑浊( )(6)100 mL 2 ml·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变( )(7)升高温度可使吸热反应的反应速率增大,使放热反应的反应速率也增大( )【答案】(1)× (2)× (3)× (4)√ (5)× (6)× (7)√
2.改变下列条件对生成产物的速率会有什么影响,填“增大”“减小”或“不变”。(1)对于Fe+2HCl===FeCl2+H2↑①升高温度:__________________;②增大盐酸浓度:__________________;③增大铁的质量:__________________;④增加盐酸体积:__________________;
⑤把铁片改成铁粉:______________;⑥滴入几滴CuSO4溶液:______________;⑦加入NaCl固体:____________________;⑧加入CH3COONa固体:____________________;⑨加入一定体积的Na2SO4溶液:____________________。
(2)一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行。①缩小体积使压强增大:______________;②恒容充入N2:______________;③恒容充入He:______________;④恒压充入He:______________。【答案】(1)①增大 ②增大 ③不变 ④不变 ⑤增大 ⑥增大 ⑦不变 ⑧减小 ⑨减小(2)①增大 ②增大 ③不变 ④减小
1.对反应A+B===AB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 ml ②50 mL溶液中含A、B各0.05 ml ③0.1 ml·L-1的A、B溶液各10 mL ④0.5 ml·L-1的A、B溶液各50 mL四者反应速率的大小关系是( )A.②>①>④>③ B.④>③>②>①C.①>②>④>③ D.①>②>③>④【答案】A
外界条件对化学反应速率的影响★★★★
2.(2018·山东烟台质检)反应C(s)+H2O(g)===CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大A.①④ B.②③ C.①③ D.②④【答案】C 【解析】增大固体的量、恒容时充入不参与反应的气体对化学反应速率无影响。
3.(2019·云南丽江测试)少量铁粉与100 mL 0.01 ml/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)A.①⑥⑦ B.③⑦ C.③⑤⑥ D.③⑥⑦【答案】B
分析外界因素对化学反应速率的影响时需注意的问题(1)对于固体和纯液体反应物,其浓度可视为常数,改变用量速率不变。但固体颗粒的大小(比表面积)决定反应物接触面积的大小,会影响化学反应速率。
4.(2017·浙江卷,21)对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(ml·L-1)随时间(min)变化的有关实验数据见表。下列说法不正确的是( )
控制变量法探究影响化学反应速率的因素★★★★
A.在0~20 min内,Ⅰ 中M的分解速率为0.015 ml·L-1·min-1B.水样酸性越强,M的分解速率越快C.在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快【答案】D
【解析】在0~20 min内,Ⅰ中M的物质的量浓度变化0.3 ml/L,M的分解速率为0.3 ml·L-1/20 min=0.015 ml·L-1·min-1,A项正确;对比Ⅰ、Ⅱ组数据,0~25 min内,Ⅰ中M的物质的量浓度变化0.31 ml/L,Ⅱ中M的物质的量浓度变化0.24 ml/L,则酸性越强,速率越快,B项正确;在0~20 min内,Ⅲ中M的浓度变化0.13 ml/L,分解百分率为0.13/0.2=0.65,Ⅱ中变化0.22 ml/L,分解百分率为0.22/0.4=0.55,则Ⅲ中M的分解百分率比Ⅱ大,C项正确;由于pH不同,不能比较Ⅳ中M的分解速率比Ⅰ快,D项错误。
利用“控制变量法”的解题策略
5.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
【答案】(1)2 2.5 (2)②和③ ①和②(3)
【解析】(1)H2C2O4中碳的化合价是+3价,CO2中碳的化合价为+4价,故每消耗1 ml H2C2O4转移2 ml电子,配平反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O,为保证KMnO4完全反应,c(H2C2O4)∶c(KMnO4)≥2.5。(2)探究温度对反应速率的影响,则浓度必然相同,则为实验②和③;同理探究浓度对反应速率的影响的实验是①和②。(3)温度降低,化学反应速率减小,故KMnO4褪色时间延长,故作图时要同时体现25 ℃ MnO浓度降低比50 ℃时MnO的浓度降低缓慢,且反应完全时间比50 ℃时“拖后”。
有关化学反应速率的几种图像★★★
Ⅰ Ⅱ
Ⅲ Ⅳ
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态【答案】B 【解析】A项,根据“先拐先平”数值大知,乙的温度高,随着反应的进行,SO2的浓度是减小的而非增大,错误;B项,使用催化剂,v(正)、v(逆)同时增大,且倍数相同,断点应在原平衡反应速率之上,正确;C项,增大O2浓度,正反应速率会突然增大且图像上“断点”应在原平衡速率之上,但逆反应速率应在原来的基础上逐渐增大,错误;D项,a、b、c三点是在不同温度下的平衡曲线上,错误。
【解析】分析时要注意改变条件瞬间v正、v逆的变化。增加O2的浓度,v正增大,v逆瞬间不变,A项正确;增大压强,v正、v逆都增大,v正增大的倍数大于v逆,B项正确;升高温度,v正、v逆都瞬间增大,C项错误;加入催化剂,v正、v逆同时同倍数增大,D项正确。
相关课件
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第3节考点2化学反应进行的方向 (含解析),共16页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,一定能,一定不能,思维深化,考点突破等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第2节考点2化学平衡的移动 (含解析),共22页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第2节考点3“等效平衡”原理及其应用 (含解析),共20页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,思维深化,考点突破,答案B等内容,欢迎下载使用。









