






所属成套资源:(通用版)高考化学一轮复习考点课件 (含解析)
(通用版)高考化学一轮复习课件第八章水溶液中的离子平衡第2节考点3酸碱中和滴定 (含解析)
展开
这是一份(通用版)高考化学一轮复习课件第八章水溶液中的离子平衡第2节考点3酸碱中和滴定 (含解析),共35页。PPT课件主要包含了考点3酸碱中和滴定,栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。
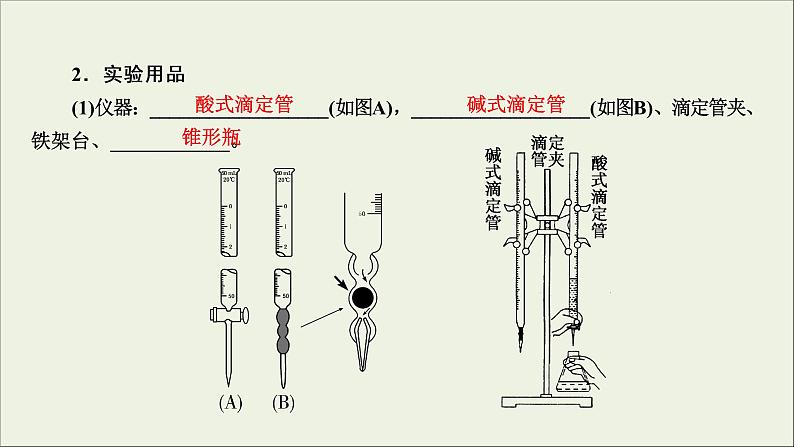
2.实验用品(1)仪器:__________________(如图A),__________________(如图B)、滴定管夹、铁架台、____________。
(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管的使用:①酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易__________________。②碱性试剂一般用_________滴定管,因为碱性物质易_______________,致使旋塞粘连无法打开。
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备:①滴定管:____________→洗涤→____________→装液→调液面→记录。②锥形瓶:注碱液→记体积→加指示剂。(2)滴定:
4.常用酸碱指示剂及变色范围
1.判断正误(正确的画“√”,错误的画“×”)。(1)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL( )(2)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差( )(3)滴定管的读数为24.6 mL( )(4)中和滴定时眼睛必须注意锥形瓶内溶液颜色的变化( )(5)用碱式滴定管量取20.00 mL KMnO4溶液( )
(6)滴定管在加入反应液之前一定要用所要盛装的反应液润洗2~3遍( )(7)容量为25 mL的滴定管,滴定过程中用去10.00 mL的液体,此时滴定管中剩余液体的体积为15 mL( )(8)在中和滴定实验中,滴定前盛标准液滴定管尖嘴部分有气泡,滴定后气泡消失,测定结果待测液浓度偏高( )(9)滴定终点就是酸碱恰好中和的点( )【答案】(1)× (2)× (3)× (4)√ (5)× (6)√ (7)× (8)√ (9)×
2.(1)用a ml·L-1的HCl滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是________;若用甲基橙作指示剂,滴定终点现象是___________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用_______________作指示剂,达到滴定终点的现象是________________________。(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂_____(填“是”或“否”),达到滴定终点的现象是__________。(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为_______________________,达到滴定终点时的现象是__________________。
【答案】(1)滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 当滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色(2)淀粉溶液 当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色(3)否 当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色(4)Ti3++Fe3+===Ti4++Fe2+ 当滴入最后一滴标准液,溶液变成红色,且半分钟内不褪色
酸碱中和滴定操作及误差分析★★★
【解析】进行酸碱中和滴定实验时,滴定管需要润洗,但是盛装待测液的锥形瓶使用前不能用待测液润洗,否则会导致待测液的物质的量偏大,影响滴定结果,A项错误;滴定过程中两眼应注视锥形瓶中溶液颜色的变化,以判断是否达到滴定终点,不应注视滴定管内液面变化,B项错误;滴定过程中,滴定前仰视读数导致标准液读数偏大,滴定后俯视读数导致标准液读数偏小,最终导致消耗的标准液体积偏小,测定结果偏低,C项错误;用氢氧化钠滴定盐酸,可用酚酞为指示剂,滴定终点为最后一滴标准液使酚酞由无色变为红色,且30秒不复原,D项正确。
2.(2019·江西赣州质检)某同学用0.100 0 ml·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液。(1)部分操作如下:①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙③滴定时,边滴加边振荡,同时注视滴定管内液面的变化请选出上述操作过程中存在错误的序号:__________________。
(2)某次滴定前滴定管液面如图1所示,读数为___________ mL。(3)根据正确实验结果所绘制的滴定曲线如图2所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-) +
c(CH3COOH)=c(Na+)。计算醋酸的电离常数:____________________,该CH3COOH的物质的量浓度为______________ml·L-1。【答案】(1)①②③ (2)0.30 (3)1.7×10-5 0.100 7
酸碱中和滴定曲线及微粒浓度大小分析★★★
HX的酸性比HY的弱,滴定至HX恰好完全反应时,HY也完全反应,此时溶液中的溶质为NaX和NaY,X-的水解程度比Y-的大,则有c(Y-)>c(X-),C项错误。HY和HZ混合,达到平衡时,据电荷守恒有c(H+)=c(Y-)+c(Z-)+c(OH-);对于弱酸HY来说,Ka(HY)=[c(H+)·c(Y-)]/c(HY),则有c(Y-)=[Ka(HY)·c(HY)]/c(H+),故c(H+)=[Ka(HY)·c(HY)]/c(H+)+c(Z-)+c(OH-),D项错误。
5.已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 ml·L-1 CH3COOH溶液中逐滴加入0.01 ml·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。
请回答下列有关问题(已知lg4=0.6):(1)a点溶液中c(H+)为____________,pH约为________。(2)a、b、c三点中水的电离程度最大的是____________点,滴定过程中宜选用____________作指示剂,滴定终点在____________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是____________(填字母)。
【答案】(1)4×10-4 ml·L-1 3.4 (2)c 酚酞 c点以上 (3)B
酸碱中和滴定曲线突破方法(1)三步解决酸碱中和滴定过程中的有关问题。①看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中,然后看起点,起点可以看出酸性或碱性的强弱,这个在判断滴定终点时至关重要;②找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;③分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。(2)在整个滴定过程中注意两个关系。①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸(或碱)的物质的量进行确定,但不一定为等量关系。
酸碱中和滴定在定量实验中的应用★★★
下列说法正确的是( )A.试样在甲中溶解,滴定管选乙B.选用淀粉作指示剂,当甲中溶液由蓝色变为无色时,即达到滴定终点C.图丁中滴定前,滴定管的读数为a-0.50 mLD.对装有标准液的滴定管读数时,滴定前后读数方式如图丁所示,则测得的结果偏小【答案】D
【解析】A项,甲中盛装的是含有I2的溶液,则滴定管中盛装的为Na2S2O3标准溶液,该溶液显碱性,应选用碱式滴定管(丙),不正确;B项,溶液变色且经过30 s左右溶液不恢复原来的颜色,视为滴定终点,不正确;C项,滴定管“0”刻度在上端,故滴定前的读数为a+0.50 mL,不正确;D项,滴定后俯视读数,将导致读数偏小,故测得的结果偏小,正确。
相关课件
这是一份2020版高考化学一轮复习考点备考课件8.2.3酸碱中和滴定 (含解析),共7页。PPT课件主要包含了速查速测,对终点的判断更精确,锥形瓶只水洗,指示剂恰好变色的点,或0刻度以下,典例剖析,甲基橙,反思归纳,沉淀滴定法,a点溶液为中性等内容,欢迎下载使用。
这是一份高考化学一轮复习课件第8章第3讲 酸碱中和滴定及拓展应用(含解析),共50页。PPT课件主要包含了考向1,甲基橙,锥形瓶,待装液,不恢复,考向2,训练四十等内容,欢迎下载使用。
这是一份(新高考)高考化学大一轮复习课件第8章第48讲酸碱中和反应及中和滴定(含解析),共60页。PPT课件主要包含了复习目标,氧化还原滴定,直接滴定型,连续反应型,过量试剂型,滴定终点判断,真题演练明确考向,课时精练等内容,欢迎下载使用。








