

所属成套资源:高考化学二轮复习讲义+分层训练(含解析)
高考化学二轮复习讲义+分层训练解密03氧化还原反应(讲义)
展开
这是一份高考化学二轮复习讲义+分层训练解密03氧化还原反应(讲义),共19页。
解密03 氧化还原反应
【考纲导向】
1.理解氧化还原反应的本质和特征
2.从多个角度理解氧化剂和还原剂等概念
3.会比较与判断氧化性或还原性强弱
4.知道常见的氧化剂和还原剂
5.能判断氧化还原反应中的电子转移方向和数目
6.能够利用得失电子守恒进行有关氧化还原反应的计算
7.掌握常见氧化还原反应的配平和相关计算
【命题分析】
氧化还原反应是中学化学教材中的重要概念,贯穿整个高中化学的始终,因此,它是历年高考的必考内容,填空题、简答题均有可能出现,主要考查氧化还原反应的概念与本质;判断氧化剂与还原剂、氧化产物与还原产物,被氧化元素与被还原元素;比较氧化剂(还原剂)的氧化性(还原性)的强弱;方程式的配平及简单计算。它在高考中考查形式有:(1)出现在阿伏伽德罗常数的正误判断中。在阿伏伽德罗常数的正误判断中,计算得失电子数目是常考查的一种角度,在这儿需要掌握高中一些重要物质的性质,如氯气是强氧化剂,但1molCl2在化学反应中,不一定得2mole—,如它与NaOH溶液的反应,转移电子的物质的量为1mol,还有Na2O2,它与水的反应中,也是既作氧化剂又作还原剂,有2mol的Na2O2参加反应,电子转移数为2NA。(2)出现在离子共存问题中。具有氧化性的微粒有Cl2、Na2O2 和H+、NO3—(相当于HNO3)、Fe3+、MnO4—,具有还原性的离子还有SO32—、S2—、Fe2+。(3)出现在离子方程式的正误判断中。(4)出现在简答题中根据信息书写化学方程式,能力要求高,难度较大。
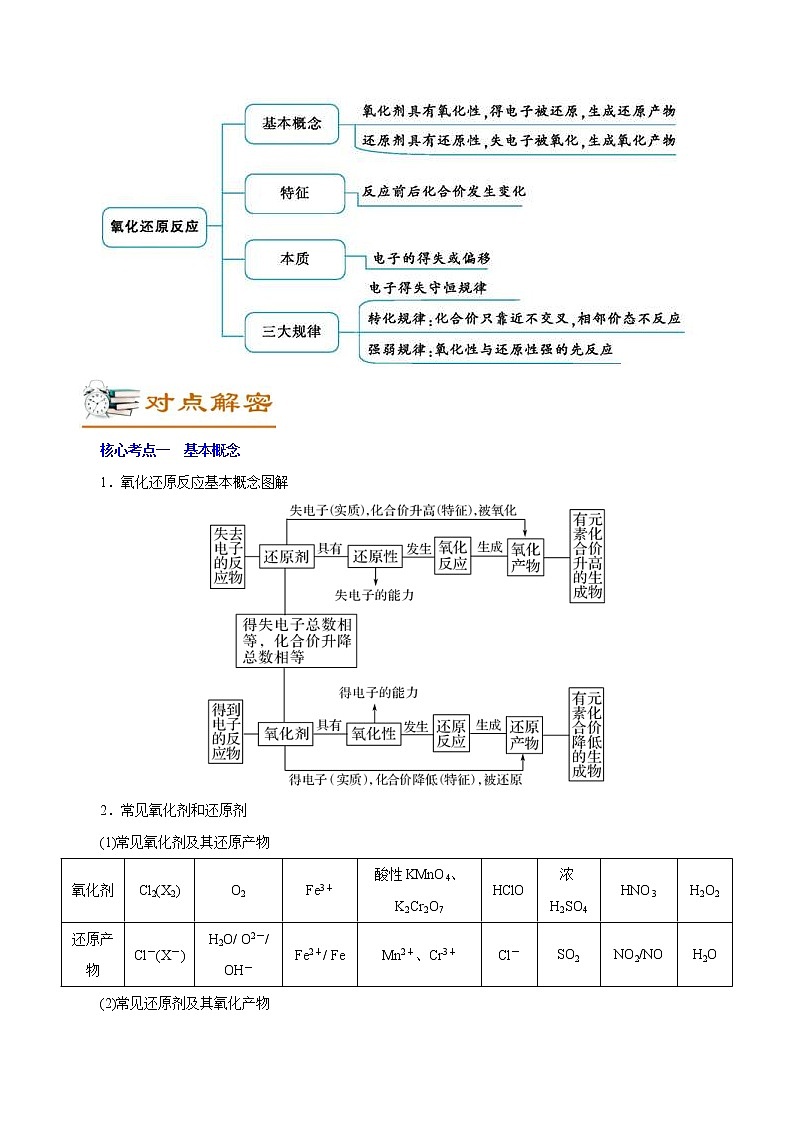
核心考点一 基本概念
1.氧化还原反应基本概念图解
2.常见氧化剂和还原剂
(1)常见氧化剂及其还原产物
氧化剂
Cl2(X2)
O2
Fe3+
酸性KMnO4、K2Cr2O7
HClO
浓H2SO4
HNO3
H2O2
还原产物
Cl-(X-)
H2O/ O2-/ OH-
Fe2+/ Fe
Mn2+、Cr3+
Cl-
SO2
NO2/NO
H2O
(2)常见还原剂及其氧化产物
还原剂
金属单质
非金属单质
Fe2+
H2S/ S2-
HI/I-
NH3
CO
SO2/SO
氧化产物
金属离子
非金属
氧化物
Fe3+
S、SO2
I2
N2、NO
CO2
SO3、SO
3.电子转移的表示方法
(1)双线桥法:①标变价,②画箭头,③算数目,④说变化。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
考法1 氧化还原反应的判断
【典例1】(2020•山东卷)下列叙述不涉及氧化还原反应的是( )
A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
【解析】A项,涉及淀粉水解成葡萄糖,葡萄糖氧化成乙醇,乙醇氧化成乙酸,涉及氧化还原反应,A不符合题意;B项,小苏打即NaHCO3,NaHCO3受热分解产生无毒的CO2,因此可用小苏打作食品膨松剂,不涉及氧化还原反应,B符合题意;C项,利用含氯消毒剂的强氧化性消毒杀菌,涉及氧化还原反应,C不符合题意;D项,NO2与水反应有HNO3产生,因此NO2参与了硝酸型酸雨的形成,涉及氧化还原反应,D不符合题意。故选B。
【答案】B
考法2 氧化还原反应的概念
【典例2】(2021年1月浙江选考)关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是
A.NH3中H元素被氧化( )
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3:4
D.氧化产物与还原产物的质量之比为4:3
【解析】由反应8NH3+6NO2==7N2+12H2O可知,其中NH3的N元素的化合价由-3升高到0、NO2中的N元素的化合价由-+4降低到0,因此,NH3是还原剂, NO2是氧化剂。A项,NH3中H元素的化合价没有发生变化,故其未被氧化,被氧化的是N元素,A不正确;B项,NO2在反应过程中得到电子,B不正确;C项,该反应中,NH3是还原剂,NO2是氧化剂。由化学方程式可知,还原剂与氧化剂的物质的量之比为4:3,C说法不正确;D项,该反应中氧化产物和还原产物均为N2。还原剂被氧化后得到氧化产物,氧化剂被还原后得到还原产物,还原剂与氧化剂的物质的量之比为4:3,因此,氧化产物与还原产物的质量之比为4:3 ,D说法正确。故选D。
【答案】D
考法3 氧化还原反应与四种基本反应类型
【典例3】下列反应既属于氧化还原反应又属于化合反应的是
A.Na2CO3+CO2+H2O===2NaHCO3 B.4Fe(OH)2+O2+2H2O===4Fe(OH)3
C.2Na2O2+2CO2===2Na2CO3+O2 D.Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
【解析】A项,Na2CO3+CO2+H2O=2NaHCO3中三种物质生成一种物质是化合反应,但反应过程中没有化合价的变化,所以不是氧化还原反应,故A不符合题意;B项,4Fe(OH)2+O2+2H2O=4Fe(OH)3三种物质生成一种物质是化合反应,反应前铁的化合价为+2价,反应后升高到+3价,为还原剂,反应前氧的化合价为0价,反应后化合价下降到-2价,为氧化剂,所以此反应为氧化还原反应,故B符合题意;C项,2Na2O2+2CO2=2Na2CO3+O2反应前两种物质,反应后为两种物质,所以不是化合反应,此反应中存在化合价的变化,为氧化还原反应,故C不符合题意;D项,Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O反应前两种物质,反应后三种物质,所以不是化合反应,反应过程中没有化合价变化,因此为非氧化还原反应,故D不符合题意;故选B。
【答案】B
考法4 氧化还原反应的电子转移
【典例4】下列表示反应中电子转移的方向和数目正确的是( )
【解析】B项,硫元素发生歧化反应,两个S由0降低为-2价,总共降低4价,一个S由0价升高为+4价,总升高4价,共失去4个电子,正确;C项,根据化合价不能交叉的原则,氯酸钾中氯元素的化合价应从+5价降到0价,盐酸中氯元素的化合价应从-1价升高到0价,转移电子数是5;D项,氯酸钾中氯元素化合价降低,得到电子,氧元素化合价升高,失去电子,箭头应该是从O指向Cl,,故D错误。
【答案】B
1.误认为有单质参与或生成的反应一定是氧化还原反应。如O2与O3的转化为非氧化还原反应。
2.误认为元素由化合态变为游离态一定被还原,其实不一定。如HCl→Cl2,氯元素被氧化,CuO→Cu,铜元素被还原。
3.误认为氧化还原反应中有一种元素被氧化,则一定有另一种元素被还原,其实不一定。如Cl2+H2OHCl+HClO中,被氧化和被还原的都是氯元素。
4.误认为具有氧化性的物质和具有还原性的物质一定都能发生化学反应,其实不一定。如SO2具有还原性,浓H2SO4具有氧化性,但二者不发生氧化还原反应。
5.误认为同种元素的高价态的物质一定比低价态物质的氧化性强,其实不一定。如HClO的氧化性高于HClO4。
明确分析问题的方法思路:找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化合价的变化情况。基本方法是先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。
1.(2020•浙江1月选考)反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化产物是( )
A.MnO2 B.HCl C.MnCl2 D.Cl2
【答案】D
【解析】氧化还原反应中还原剂失电子化合价升高被氧化得到氧化产物,该反应中HCl中氯元素由-1价升为0价得到产物Cl2,即氧化产物为Cl2;故选D。
2.(2020·浙江省7月选考)反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,氧化产物与还原产物的物质的量之比是( )
A.1:2 B.1:1 C.2:1 D.4:1
【答案】B
【解析】由反应方程式可知,反应物MnO2中的Mn元素的化合价为+4价,生成物MnCl2中Mn元素的化合价为+2价,反应物HCl中Cl元素的化合价为-1价,生成物Cl2中Cl元素的化合价为0价,故MnCl2是还原产物,Cl2是氧化产物,由氧化还原反应中得失电子守恒可知,n(Cl2):n(MnCl2)=1:1,B符合题意;故选B。
3.(2020•北京卷)水与下列物质反应时,水表现出氧化性的是( )
A.Na B.Cl2 C.NO2 D.Na2O
【答案】A
【解析】A项,2Na+2H2O=2NaOH+H2↑,H2O中H元素化合价由+1降为0价,得电子被还原,做氧化剂,在反应中表现出氧化性,故A符合题意;B项,Cl2+H2OHCl+HClO,H2O中的元素没有发生化合价的变化,水在反应中既不是氧化剂也不是还原剂,既不表现氧化性也不表现还原性,故B不符合题意;C项,3NO2+H2O=2HNO3+NO,H2O中的元素没有发生化合价的变化,水在反应中既不是氧化剂也不是还原剂,既不表现氧化性也不表现还原性,故C不符合题意;D项,Na2O + H2O = 2NaOH,该反应没有元素化合价变化,不是氧化还原反应,水在反应中既不表现氧化性也不表现还原性,故D不符合题意;故选A。
4.(2019•北京卷)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
【答案】B
【解析】A项,FeCl3与Fe反应生成FeCl2,FeCl3+Fe=2FeCl2,此过程中Fe的化合价发生变化,涉及到了氧化还原法应,故A不符合题意;B项,MgCl2与NaOH溶液发生复分解反应MgCl2+2NaOH=Mg(OH)2 +2NaCl,过量的NaOH溶液可用HCl除去HCl+NaOH=NaCl+H2O ,此过程中没有元素化合价发生变化,未涉及氧化还原反应,故B符合题意;C项,部分氯气与H2O 发生反应生成氯化氢和次氯酸,反应过程中氯元素化合价变化,涉及到了氧化还原法应,故C不符合题意;D项,NO2 与水反应生成硝酸和NO。反应过程中氮元素化合价发生变化,涉及到了氧化还原法应,故D不符合题意;故选B。
5.下列属于氧化还原反应,且氧化剂和还原剂为同一种物质的是( )
A.MgO+2HCl=MgCl2+H2O B.C+H2O(g)CO+H2
C.8NH3+6NO27N2+12H2O D.2Na2O2+2H2O=4NaOH+O2↑
【答案】D
【解析】A项,MgO+2HCl=MgCl2+H2O中元素化合价没有发生变化,反应不是氧化还原反应,A不符合题意;B项,C+H2O(g)CO+H2中C、H两种元素的化合价都发生了变化,反应属于氧化还原反应,其中C是还原剂,H2O是氧化剂,氧化剂和还原剂不是同一种物质,B不符合题意;C项,8NH3+6NO27N2+12H2O中只有N元素的化合价发生了变化,反应属于氧化还原反应,其中NH3是还原剂,NO2是氧化剂,氧化剂和还原剂不是同一种物质,C不符合题意;D项,反应2Na2O2+2H2O=4NaOH+O2↑中有O元素化合价的变化,反应属于氧化还原反应,其中Na2O2既是还原剂也是氧化剂,氧化剂和还原剂是同一种物质,D符合题意;故选D。
6.(2018•北京卷)下列实验中的颜色变化,与氧化还原反应无关的是( )
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
【答案】C
【解析】A项,NaOH溶液滴入FeSO4溶液中产生白色Fe(OH)2沉淀,白色沉淀变为红褐色沉淀时的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应前后元素化合价有升降,为氧化还原反应;B项,氯水中存在反应Cl2+H2OHCl+HClO,由于氯水呈酸性,石蕊溶液滴入后溶液先变红,红色褪色是HClO表现强氧化性,与有色物质发生氧化还原反应;C项,白色沉淀变为黑色时的反应为2AgCl+Na2S=Ag2S+2NaCl,反应前后元素化合价不变,不是氧化还原反应;D项,Cu与稀HNO3反应生成Cu(NO3)2、NO气体和H2O,气体由无色变为红棕色时的反应为2NO+O2=2NO2,反应前后元素化合价有升降,为氧化还原反应;与氧化还原反应无关的是C项,故选C。
7.(2017•天津卷)下列能量转化过程与氧化还原反应无关的是( )
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
【答案】A
【解析】A项,硅太阳能电池主要是以半导体材料为基础,利用光电材料吸收光能后发生光电转换反应,与氧化还原反应无关;B项,锂离子电池工作时,涉及到氧化还原反应;C项,电解质溶液导电实质是电解的过程,与氧化还原反应有关;D项,葡萄糖供能时,涉及到生理氧化过程。故选A。
8.下列反应中,氧化产物与还原产物为同一种物质的是( )
A.KClO3 + 6HCl = KCl+ 3Cl2↑+ 3H2O B.2Na+2H2O=2NaOH+H2↑
C.2Na2O2+2H2O=4NaOH+O2↑ D.I2+2Na2S2O3 = 2NaI + Na2S4O6
【答案】A
【解析】A项,KClO3 + 6HCl = KCl+ 3Cl2↑+ 3H2O 反应中KClO3中Cl元素的化合价由+5价降低为0,HCl 中Cl元素的化合价由-1价升高为0,Cl2既是氧化产物也是还原产物,故A选;B项,2Na+2H2O=2NaOH+H2↑反应中Na元素的化合价升高,NaOH为氧化产物,H元素的化合价降低,氢气为还原产物,故B不选;C项,2Na2O2+2H2O═4NaOH+O2↑反应中Na2O2中O元素的化合价由-1价升高到0价,氧化产物是氧气,O元素的化合价由-1价降低到-2价,还原产物为氢氧化钠,故C不选;D项,I2+2Na2S2O3 = 2NaI + Na2S4O6反应中I元素的化合价由0价降低到-1价,还原产物为NaI,S元素的化合价由+2价升高到价,氧化产物是Na2S4O6,故D不选;故选A。
核心考点二 氧化还原反应的基本规律
1.氧化还原反应的基本规律
守恒律
定义
化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。即n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
应用
①直接计算参与氧化还原反应物质间的数量关系。
②配平氧化还原反应方程式。
强弱律
定义
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
应用
①判断某氧化还原反应中,氧化性、还原性的相对强弱。
②判断某氧化还原反应能否正常进行。
优先律
定义
当存在多种还原剂(氧化剂)时,氧化剂(还原剂)通常先和还原性(氧化性)最强的还原剂(氧化剂)反应。
应用
①判断某一氧化还原反应能否正常进行。
②可判断物质发生氧化还原反应的先后顺序。
如:向NaBr和NaI的混合溶液中通入Cl2,因I-的还原性强于Br-,则先发生反应:2I-+Cl2===2Cl-+I2,然后发生反应:2Br-+Cl2===2Cl-+Br2。
价态律
定义
有多种价态的元素,处于最高价态时只具有氧化性(如H2SO4中的S元素),处于最低价态时只具有还原性(如H2S中的S元素),处于中间价态时既有氧化性又有还原性(如SO2中的S元素)。
应用
①判断氧化还原反应能不能发生。
②判断同种元素的不同物质间发生氧化还原反应时的化合价变化情况。
转化律
定义
同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多达到同种价态。
应用
如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O(H2→,H2O4→O2)、5Cl-+ClO+6H+===3Cl2↑+3H2O。
2.物质氧化性、还原性强弱的应用
物质氧化性、还原性强弱判断的常用方法
(1)依据反应条件来判断。
当不同的氧化剂作用于同一还原剂时,若氧化产物价态相同,可依据反应条件的难易程度来判断氧化剂氧化性的相对强弱,一般来说反应条件越苛刻,说明反应越难发生(即氧化剂得电子越困难),则对应氧化剂的氧化性越弱,例如:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
氧化性:浓硝酸>浓硫酸。
(2)根据“三表”判断。
①根据元素周期表判断
②根据金属及非金属的活动性顺序表判断
(3)依据“两池”判断。
①两种不同的金属构成原电池的两极时,负极是电子流出的一极,正极是电子流入的极。则两种金属的还原性:正极<负极。
②用惰性电极电解混合溶液时,在阴极先得电子的阳离子的氧化性较强,在阳极先失去电子的阴离子的还原性较强。
(4)依据“三度”判断(即:浓度、温度、酸碱度)。
一般情况下,浓度越大,温度越高,氧化剂的氧化性(或还原剂的还原性)越强;酸碱度是影响氧化性强弱的重要因素。
例如:①KMnO4在酸性条件下具有较强的氧化性,常温下即可和浓盐酸反应制取氯气;②HNO3(浓)的氧化性强于HNO3(稀)的氧化性;③HNO3(热)的氧化性强于HNO3(冷)的氧化性。
考法1 氧化性、还原性强弱的判断
【典例1】常温下,在溶液中可发生以下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2M2++R2===2M3++2R-
③2R-+Z2===R2+2Z-
由此判断下列说法错误的是( )
A.氧化性强弱顺序为XO
相关试卷
这是一份高考化学二轮复习解密03 氧化还原反应(讲义)(含解析),共14页。
这是一份高考化学二轮复习讲义+分层训练解密13有机化学基础(讲义),共58页。
这是一份高考化学二轮复习讲义+分层训练解密12实验化学(讲义),共77页。








