




所属成套资源:2022年高考化学一轮复习高频考点集训(2份打包,解析版+原卷版,可预览)
- 2022年高考化学一轮复习高频考点集训专题02 化学物质及其变化(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题03 金属及其化合物(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题05 人教版必修一(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题06 高中化学人教版必修二(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题07 物质结构 元素周期律(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
2022年高考化学一轮复习高频考点集训专题04 非金属及其化合物(2份打包,解析版+原卷版,可预览)
展开
这是一份2022年高考化学一轮复习高频考点集训专题04 非金属及其化合物(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题04非金属及其化合物解析版doc、2022年高考化学一轮复习高频考点集训专题04非金属及其化合物原卷版doc等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
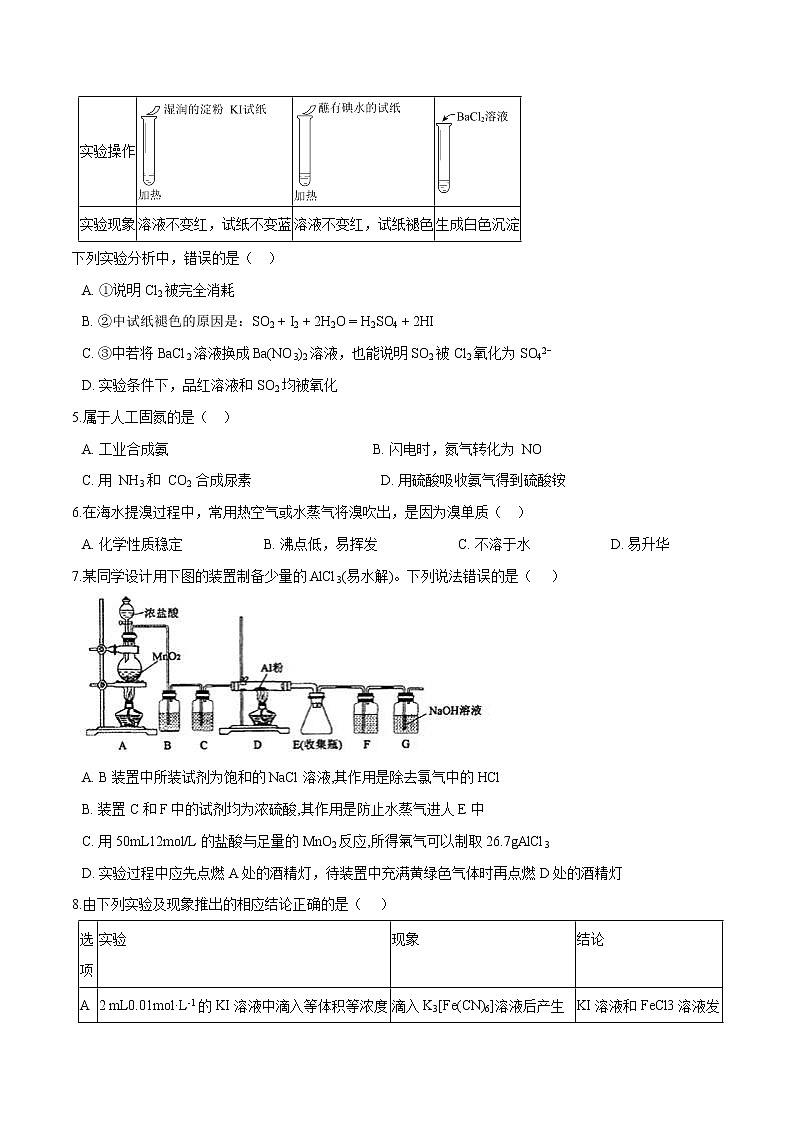
专题04 非金属及其化合物一、单选题1.下列涉及化学学科观点的有关说法正确的是( ) A. 微粒观:二氧化硫是由硫原子和氧原子构成的 B. 转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和
C. 守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g D. 结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异2.化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:下列关于合成氨反应的叙述中错误的是( )A. 该过程表明,在化学反应中存在化学键的断裂与形成 B. 在催化剂的作用下,反应物的化学键变得容易断裂
C. 过程②需吸收能量,过程③则放出能量 D. 常温下该反应难以进行,是因为常温下生成物的化学键难以形成3.下列所示物质的工业制备方法合理的是( ) A. 制Si:SiO2 SiCl4 Si B. 制H2SO4:黄铁矿 SO2 H2SO3 H2SO4C. 卤水中提取Mg:卤水(主要含MgCl2) Mg(OH)2 MgCl2 Mg D. 侯氏制碱法:饱和食盐水 NaHCO3(s) Na2CO34.某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下: 序号 实验操作实验现象溶液不变红,试纸不变蓝溶液不变红,试纸褪色生成白色沉淀下列实验分析中,错误的是( )A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O = H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−
D. 实验条件下,品红溶液和SO2均被氧化5.属于人工固氮的是( ) A. 工业合成氨 B. 闪电时,氮气转化为 NO
C. 用 NH3和 CO2 合成尿素 D. 用硫酸吸收氨气得到硫酸铵6.在海水提溴过程中,常用热空气或水蒸气将溴吹出,是因为溴单质( ) A. 化学性质稳定 B. 沸点低,易挥发 C. 不溶于水 D. 易升华7.某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氣气可以制取26.7gAlCl3 D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯8.由下列实验及现象推出的相应结论正确的是( )选项实验现象结论A2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝KI溶液和FeCl3溶液发生反应:2Fe3++2I- 2Fe2++I2B向稀硫酸中加入铜片,然后通入氧气加热先无明显现象,通入氧气加热后溶液变蓝氧化性:稀硫酸>Cu2+C向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞Na2SiO3溶液红色更深非金属性:Si<SD将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中只产生红褐色沉淀Ksp[Al(OH)3]>K sp[Fe(OH)3]9.为了从海带浸取液中提取碘,某同学设计了如下实验方案:下列说法正确的是( )A. ①中反应的离子方程式:2I− + H2O2 = I2 + 2OH− B. ②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C. ③中得到的上层溶液中含有I− D. 操作Z的名称是加热10.常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是( ) A. 曲线③~④段有离子反应:HClO+OH-=ClO-+H2O B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯气与氢氧化钠溶液恰好反应完全 D. ①处c(H+)约为②处c(H+)的2倍11.工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( ) A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4 , ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸12.X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是( ) XYZ箭头上所标数字的反应条件 A.NONO2HNO3①常温遇氧气B.Cl2NaClOHClO②通入CO2C.Na2O2NaOHNaCl③加入H2O2D.Al2O3NaAlO2Al(OH)3④加NaOH溶液13.下列有关实验原理、方法和结论都正确的是()A. 已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜
B. 用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度
C. 取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
D. 用饱和碳酸钠溶液多次洗涤BaCO3 , 可除去BaCO3中少量的BaSO4 , 说明Ksp(BaCO3)<Ksp(BaSO4)14.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是A. 溶液中一定存在Br-、CO32- B. 溶液中可能存在NH4+
C. 溶液中一定不存在Fe2+、I-、SO32- D. 溶液一定呈酸性 二、综合题15.某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行有关探究实验。 实验Ⅰ.制取氯酸钾、次氯酸钠和氯水(1)写出装置A实验室制取Cl2的化学方程式________。 (2)制取实验结束后,取出装置B中试管,冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。为提高氯酸钾和次氯酸钠的产率,在实验 装置中还需要改进的是________。 (3)装置C中反应需要在冰水浴中进行,其原因是________。 (4)装置D中的实验现象是溶液先变红后褪色,最后又变为________色。 (5)实验Ⅱ.尾气处理 实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。①提出合理假设假设1:只存在SO32-;假设2:即不存在SO32- , 也不存在ClO-;假设3:________。②设计实验方案,进行实验。请完成下列表格,写出相应的实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH溶液、0.01 mol·L-1酸性KMnO4溶液、淀粉KI溶液。实验步骤预期现象和结论步骤1:取少量吸收液分置于A、B试管中 步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液a.若溶液褪色,则假设1成立b.若溶液不褪色,则假设2或3成立步骤3:________________16.硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下: 某化学兴趣小组同学模拟该流程设计了如下实验装置:回答下列问题:(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是________(填字母) a、品红溶液 b、NaOH溶液 c、稀硫酸若要停止I中的化学反应,除停止加热外,还要采取的操作是________。(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是________;丙同学做了如下实验来验证黑色物质的组成: 基于上述假设分析,原黑色物质的组成为________(填化学式)。(3)II中发生反应的化学方程式为________,实验中通入的SO2不能过量,可能的原因是________。 (4)丁同学提出上述实验装置的设计存在不足,建议在I上________;在I、II之间增加________。 17.黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为: (1)【实验一】:测定硫元素的含量 反应结束后,将乙瓶中的溶液进行如下处理:①鼓入空气的作用是________。②反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________。H2O2可以看作是一种很弱的酸,写出其电离方程式:________。(2)该黄铁矿石中硫元素的质量分数为________(列出表达式即可)。 (3)【实验二】:测定铁元素的含量 ②中,若用铁粉作还原剂,则所测得的铁元素的含量________(填“偏大”、“偏小”或“无影响”)。(4)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。 (5)某同学一共进行了四次滴定实验,实验结果记录如下: 实验次数第一次第二次第三次第四次消耗KMnO4溶液体积/mL25.0025.0320.0024.97根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =________。 18.碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题: (1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2 , 搅拌并加热,发生反应:3I2+6NaOH 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是________,若温度过高产生的影响是________。 (2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3- , 且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸 实验操作实验现象结论①用玻璃棒蘸取溶液,点在________试纸上试纸呈蓝色c(OH-)>c(H+)②用玻璃棒蘸取溶液,点在________试纸上试纸不变色 ③向实验②的试纸上滴加________溶液试纸呈蓝色溶液中有IO3-(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为________。充分反应后,从混合物中获得NaI固体,首先应进行________(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是________。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于________g(精确到小数点后两位)。 19.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空: (1)已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是________。写出CCl4层变成紫色的离子反应方程式________。 (2)若把KI换成KBr,则CCl4层变为________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________。 (3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数________NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+( )H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:________。
相关试卷
这是一份2022年高考化学一轮复习高频考点集训专题19 烃和卤代烃(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题19烃和卤代烃解析版doc、2022年高考化学一轮复习高频考点集训专题19烃和卤代烃原卷版doc等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份2022年高考化学一轮复习高频考点集训专题17 电化学基础(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题17电化学基础解析版doc、2022年高考化学一轮复习高频考点集训专题17电化学基础原卷版doc等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份2022年高考化学一轮复习高频考点集训专题11 原子结构与性质(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题11原子结构与性质解析版doc、2022年高考化学一轮复习高频考点集训专题11原子结构与性质原卷版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。








