





高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质教学演示课件ppt
展开1. 知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。2.能说出元素电离能、电负性的含义,能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。3.能说明电负性大小与原子在化合物中吸引电子能力的关系,能利用电负性判断元素的金属性与非金属性的强弱,推测化学键的极性。
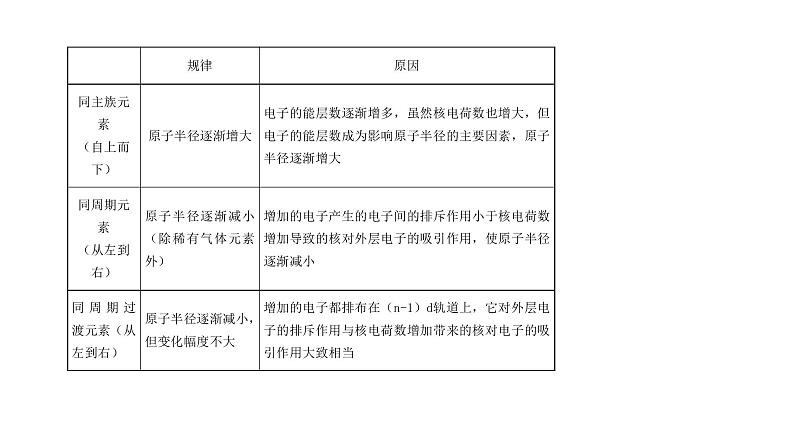
一 原子半径及其变化规律 1.影响因素
3. 比较微粒半径大小的方法(1)同周期元素,从左到右,原子半径依次减小。(2)同主族元素,从上到下,原子或同价态离子半径依次增大。(3)阳离子半径小于相应的原子半径,阴离子半径大于相应的原子半径,如r(Na+)
例 1 下列微粒半径大小比较错误的是( )A. K>Na>Li B. Na+>Mg2+>Al3+ C. Mg2+>Na+>F- D. Cl->F->F解析:A对,同主族元素,由上到下,原子半径逐渐增大。B对,核外电子排布相同的离子,核电荷数越大,离子半径越小。C错,应该为F->Na+>Mg2+。D对,同主族元素,由上到下,离子半径增大,同种元素的阴离子半径大于相应的原子半径。答案:C
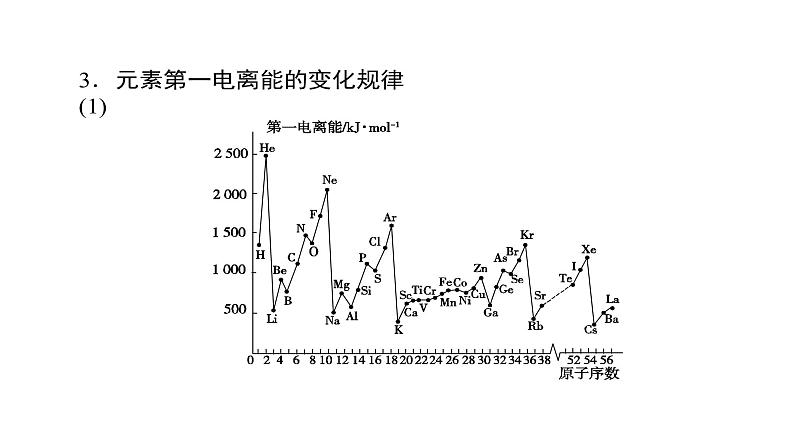
例 2 气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。已知元素X、Y的第一电离能X>Y,则下列说法正确的是A.若X与Y在元素周期表中位于同一周期,则原子序数一定X>YB.如果X与Y在元素周期表中位于同一主族,则一定X
例 3 下列有关电负性的说法中正确的是( )A.主族元素的电负性越大,元素原子的第一电离能一定越大B.在元素周期表中,元素电负性从左到右越来越小C.金属元素的电负性一定小于非金属元素的电负性D.在形成化合物时,电负性越小的元素越容易显示正价解析:A错,主族元素原子的第一电离能、电负性变化趋势基本相同,但电离能变化有起伏,如电负性:O>N,但第一电离能:O
化学选择性必修2第二节 原子结构与元素的性质授课ppt课件: 这是一份化学选择性必修2第二节 原子结构与元素的性质授课ppt课件,共60页。PPT课件主要包含了知识点一,知识点一原子半径,知识点二,知识点二电离能,气态电中性基态,一个电子,最低能量,知识点三,知识点三电负性,化学键等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件: 这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件,共23页。PPT课件主要包含了旧知回顾,卤素的化学性质,元素非金属性减弱,元素金属性逐渐增强,元素非金属性逐渐减弱,键合电子,电负性,第二周期,第三周期,第四周期等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件: 这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件,共24页。PPT课件主要包含了旧知回顾,元素周期律,原子半径,电离能,原子半径的递变规律,影响原子半径的因素,电离能的递变规律,电离能的应用,核电荷数增大,电子能层数增多等内容,欢迎下载使用。













