



所属成套资源:中考总复习化学(河南地区)单元+专题复习课件
中考总复习化学(河南地区)2.第二单元 我们周围的空气课件
展开这是一份中考总复习化学(河南地区)2.第二单元 我们周围的空气课件,共60页。PPT课件主要包含了目录河南·中考,考点一,速记口诀,混合物,稀有气体,03%,保护气,供给呼吸,支持燃烧,混合物和纯净物等内容,欢迎下载使用。
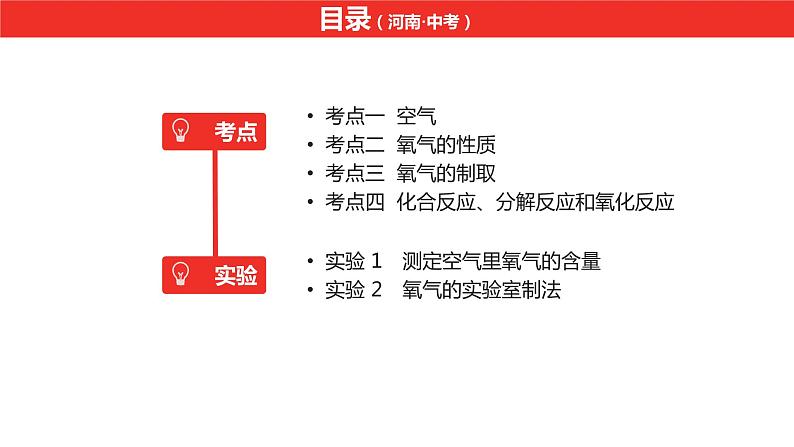
考点一 空气考点二 氧气的性质考点三 氧气的制取考点四 化合反应、分解反应和氧化反应
实验 1 测定空气里氧气的含量实验 2 氧气的实验室制法
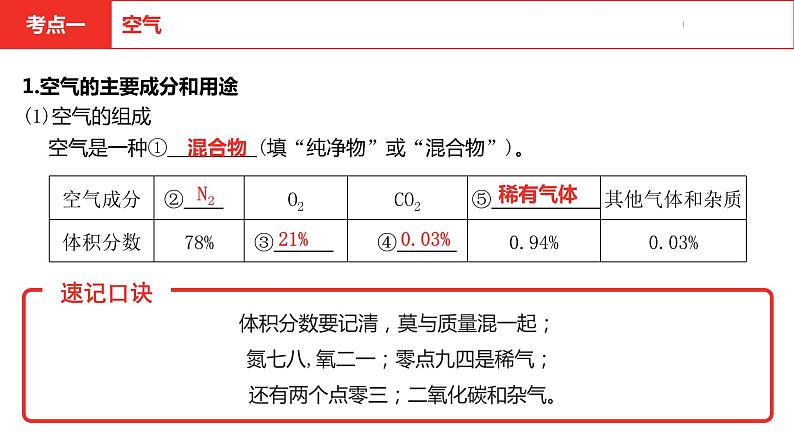
1.空气的主要成分和用途(1)空气的组成
体积分数要记清,莫与质量混一起;氮七八,氧二一;零点九四是稀气; 还有两个点零三;二氧化碳和杂气。
空气是一种① (填“纯净物”或“混合物”)。
(2)空气的主要成分的用途
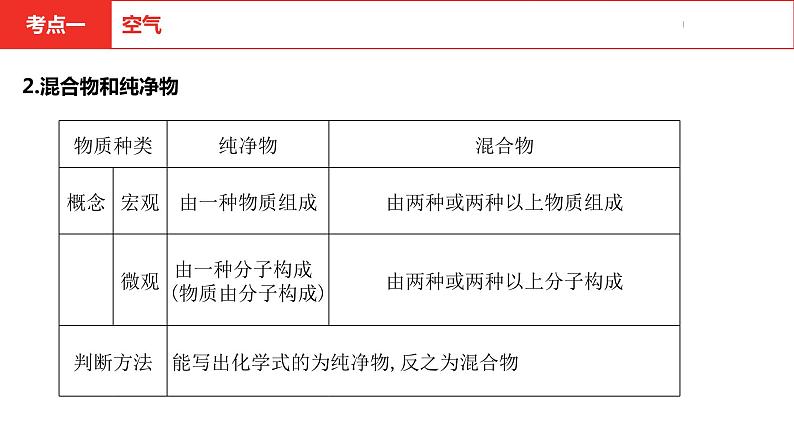
初中常见的纯净物和混合物混合物:空气(或洁净的空气)、溶液(盐酸、生理盐水)、合金、石油、天然气等。纯净物:冰水共存物、液氧、液氢、干冰、铁等。
【归纳总结】 目前全球三大大气污染问题:全球气候变暖(CO2、CH4等)、酸雨(SO2、NO2)、臭氧层破坏(氟利昂等)。
辨析易错易混·正误判断
1.空气中二氧化碳的含量过高会造成温室效应增强,因此二氧化碳属于空气污染物。 ( )2.pH<7的降雨是酸雨。 ( )3.由同种元素组成的物质一定是纯净物。 ( )
【分析】 二氧化碳是空气的成分之一,不属于空气污染物。
【分析】 酸雨是pH<5.6的降雨。
【分析】 有些元素可以形成多种单质,如碳元素形成的单质有金刚石、石墨、C60等;磷元素形成的单质有红磷、白磷;氧元素形成的单质有氧气、臭氧。如氧气和臭氧的混合物就是由同种元素组成的,但不属于纯净物。
即时小练
1.下列有关空气的说法不正确的是 ( ) A.空气中氮气约占总质量的78% B.空气中的氧气主要来源于植物的光合作用 C.氮气的化学性质不活泼,常用作保护气 D.洁净的空气、天然水均为混合物
2.请将下面有关空气成分的用途及其利用的性质连线。
标准状况下,氧气是一种无色、无味的气体,密度比空气 , 溶于水,有三态变化,固体和液体为淡蓝色。
(1)氧气是一种化学性质比较 的气体,能支持燃烧。
剧烈燃烧,火星四射,放热,生成黑色固体
3Fe+2O2 Fe3O4
4P+5O22P2O5
C+O2 CO2
2Mg+O2 2MgO
2H2+O2 2H2O
(1)做铁丝在氧气中燃烧的实验时,预先在集气瓶中加入少量水或铺一层细沙,目的是防止熔融物溅落使瓶底炸裂。铁丝盘成螺旋状的目的是增大受热面积。(2)做硫燃烧的实验时,预先在集气瓶中放入少量水,目的是吸收生成的二氧化硫气体,防止其污染空气;若用氢氧化钠溶液代替水,吸收效果更好,发生反应的化学方程式为2NaOH+SO2 Na2SO3+H2O。
1.鱼类能在水中生存,说明氧气易溶于水。 ( ) 2.氧气能使带火星的木条复燃,说明氧气具有可燃性。 ( ) 3.氧气的化学性质比较活泼,能与所有物质发生反应。 ( )
【分析】 氧气不易溶于水。
【分析】 氧气具有助燃性,没有可燃性。
【分析】 氧气不能与所有物质发生反应。
1.[2020郑州适应性测试]下列物质在氧气中能燃烧但在空气中不能燃烧的是( )A.铁丝 B.镁条 C.木炭 D.红磷
【解析】 铁丝在空气中不能燃烧,在氧气中能燃烧。镁条、木炭、红磷在空气和氧气中都能燃烧,在氧气中燃烧更剧烈。
2.下列对实验现象的描述正确的是 ( ) A.红磷在空气中燃烧产生大量白色烟雾 B.木炭在空气中燃烧有黑色固体生成 C.镁条在空气中燃烧发出耀眼白光 D.铁丝在氧气中燃烧火星四射、生成四氧化三铁
3.[2019湖北宜昌]如图是硫在空气和氧气中燃烧的实验。下列说法不正确的是( ) A.氧气含量越多,硫燃烧越剧烈 B.硫在氧气中燃烧发出蓝紫色火焰 C.瓶底的水可以吸收生成的有害气体 D.硫在空气和氧气中燃烧的生成物不同
【解析】 硫在空气和氧气中燃烧的生成物都是二氧化硫,D不正确。
物质燃烧现象的描述(1)方法:描述实验现象时围绕“一光二热三生成”,即:①燃烧时产生的光(或火焰、烟、雾)的颜色;②放出热量;③生成物的颜色、状态、气味或其他性质。(2)注意事项
分离液态空气法:利用液氧和液氮的 不同,通过分离液态空气制得氧气,属于 变化。
2.氧气的实验室制法(详见实验)
(1)定义:在化学反应中,能 其他物质的化学反应速率,而本身的 和 在化学反应前后都没有发生变化的物质。在化学反应中,催化剂起 作用。
(2)影响化学反应速率的因素:①催化剂:在其他条件不变时,使用催化剂可以改变化学反应速率。如二氧化锰可加快过氧化氢分解的速率。②温度:其他条件不变时,升高温度可以加快化学反应速率。如食物在夏天比在冬天容易变质。 ③反应物的浓度:其他条件不变时,增大反应物的浓度可以加快化学反应速率。如硫在氧气中燃烧比在空气中燃烧剧烈。 ④反应物的接触面积:其他条件不变时,增大反应物的接触面积,可以加快化学反应速率。如相同条件下,煤粉比煤块燃烧剧烈。
1.[2020云南昆明模拟]空气是一种宝贵的自然资源,下列说法正确的是( )A.氧气能支持燃烧,可作燃料B.空气成分中体积分数最大的是氮气C.工业上利用液氮和液氧的密度不同制取氧气D.空气污染指数越大,空气质量状况越好
【解析】 氧气能支持燃烧,具有助燃性,没有可燃性,所以氧气不可作燃料,A错误;空气成分中体积分数最大的是氮气,约占空气体积的78%,B正确;工业上利用液氮和液氧的沸点不同制取氧气,C错误;空气污染指数越大,空气质量状况越差,D错误。
2.下列关于催化剂的说法正确的是 ( )A.化学反应前后催化剂的质量不变B.化学反应前后催化剂的性质不变C.催化剂只能加快化学反应速率D.没有催化剂化学反应不能发生
3.[2010河南]许多因素会影响化学反应速率。请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的。示例:硫在纯氧中燃烧比在空气中进行得更快,更剧烈。答:增大反应物浓度,可以加快化学反应速率。(1)同种食品在夏天比冬天更容易变质。(2)过氧化氢溶液在常温下能缓慢分解,加入少量MnO2时分解加速。(3)在相同质量的锌粉和锌粒中分别加入足量10%的稀盐酸,前者先反应完。
升高温度,可以加快化学反应速率。
使用催化剂,可以加快化学反应速率。
增大反应物的接触面积,可以加快化学反应速率。
(1)催化剂可以改变化学反应速率(加快或减慢),但不会影响生成物的质量。(2)催化剂的质量和化学性质在化学反应前后保持不变,但其物理性质往往会发生变化。
化合反应、分解反应和氧化反应
1.化合反应和分解反应(基本反应类型)
2.氧化反应(不是基本反应类型)
(1)概念:物质与 发生的反应。
3.化合反应和氧化反应的关系氧化反应和化合反应是两个不同范畴的概念,它们分别阐释的角度不同。化合反应是从反应物、生成物的种类来考虑,氧化反应则是从反应中有无与氧结合来考虑,但它们之间有一定的联系(如图所示)。
3.化合反应和氧化反应的关系
(1)化合反应不一定是氧化反应(a区),如:CO2+H2O H2CO3,是化合反应,不是氧化反应;(2)氧化反应不一定是化合反应(b区),如:CH4+2O2 CO2+2H2O,是氧化反应,不是化合反应;(3)某些反应可能既是氧化反应又是化合反应(c区),如:C+O2 CO2。
1.[2020江苏南京]下列变化过程中,不包含缓慢氧化的是 ( ) A.动植物的呼吸B.醋的酿造C.食物的腐烂D.水的蒸发
2.下列变化涉及的反应属于氧化反应的是 ( )A.用高锰酸钾制取氧气B.钢铁生锈C.用双氧水制取氧气D.石蜡受热熔化
【解析】 缓慢氧化是物质跟氧气发生的氧化反应,水蒸发是物理变化,不包含缓慢氧化。
3.化学概念在逻辑上存在如图所示的关系。(1)判断:化合反应和氧化反应属于 关系,纯净物和混合物属于 关系,单质和化合物属于 关系,化合物和氧化物属于 关系。 (2)写出一个既是氧化反应又是化合反应的化学方程式: ;写出一个是氧化反应但不是化合反应的化学方程式: 。
S+O2 SO2(合理即可)
CH4+2O2 2H2O+CO2(合理即可)
有氧气参加的化合反应是氧化反应。
1.实验原理:物质在密闭的容器中燃烧,消耗空气中的氧气,使容器中压强减小,由于压强差,烧杯中的水进入集气瓶内,进入集气瓶内的水的体积约等于消耗的氧气的体积。2.实验药品:红磷3.反应原理:红磷燃烧的化学方程式为 。 4.实验装置:
4P+5O2 2P2O5
5. 实验现象:(1)红磷燃烧,产生大量白烟;(2)装置冷却至室温后,打开弹簧夹,烧杯中的水进入集气瓶内,进入集气瓶内的水的体积约占原集气瓶剩余容积的五分之一。6.实验结论:空气中氧气的体积约占空气总体积的 。 7.实验拓展:实验结束后,集气瓶内剩余气体的主要成分为 ,根据实验现象分析,该气体具有的物理性质是 ,化学性质是 。
实验中用其他药品替代红磷应该满足什么条件?(1)木炭、硫粉能否替代红磷? (2)镁、铁丝能否替代红磷?
不能。木炭和硫粉燃烧时有气体生成,导致集气瓶内气体压强没有明显变化,测得的实验结果误差过大。
不能。镁在空气中燃烧时,不仅能与氧气反应,还能与氮气、二氧化碳发生反应;铁丝在空气中不能燃烧。
【总结】红磷的替代品应满足的条件是:①能与空气中的氧气反应而不与空气中的其他物质反应;②生成物不能是气体(可以是固体或液体),或生成的气体能被液体吸收。
甲 乙(1)点燃方式:如甲装置所示,利用太阳光点燃红磷,对环境无污染且减小测量误差。(2)测量方法:甲装置中集气瓶内剩余的容积及量筒中水的体积变化;乙装置中活塞移动的距离,最终活塞停在刻度 处。
丙 丁可用加热铜丝的方法测定(如丙装置),玻璃管中发生反应的化学方程式为 ;也可利用铁生锈的原理测定(如丁装置),在实验时,通常将棉花换为活性炭和食盐,其目的是 。
2Cu+O2 2CuO
12.测定空气里氧气含量的数字化实验
(1)某兴趣小组利用气压传感器测定红磷燃烧时集气瓶内气压变化情况,实验装置如图1所示。点燃红磷后,立即将燃烧匙伸入集气瓶中并塞紧瓶塞,待红磷熄灭并冷却后,打开弹簧夹。测得集气瓶内气压的变化情况如图2。下列说法错误的是 。 图1 图2A.BC段气压增大的主要原因是红磷燃烧放热B.CD段气压减小的主要原因是集气瓶内的氧气不断被消耗C.DE段气压增大的主要原因是烧杯中的水进入集气瓶D.若用木炭代替红磷完成此实验,集气瓶内的气压变化趋势与图2基本一致
(2)实验室分别用足量红磷(曲线ab)和白磷(曲线ac)燃烧测定密闭容器内空气中氧气的含量,实验过程中用氧气传感器测得密闭容器内氧气含量随时间的变化如图所示。
①红磷燃烧的化学方程式是什么?
4P+5O2 2P2O5
②红磷燃烧消耗氧气的能力 (填“大于”“小于”或“等于”)白磷,燃烧红磷的方法不能准确测定密闭容器内空气中氧气含量的原因是什么?
红磷在氧气浓度较低时不能燃烧(或红磷不能将空气中的氧气消耗尽)。
实验特训
1.[2020黑龙江牡丹江]测定空气中氧气含量的实验装置如图所示,下列有关说法正确的是( )
A.燃烧匙中的红磷可以换成硫或木炭B.选用红磷是因为反应只消耗O2,生成固态的P2O5C.装置内水位不会发生变化D.本实验可以证明空气含有N2、O2、CO2和稀有气体
2.[2020北京]利用下图装置验证了空气中氧气的含量。下列叙述不正确的是( )A.实验前需检查装置气密性B.白磷的作用是消耗试管中的氧气C.白磷熄灭、试管冷却后再打开止水夹D.最终量筒中液面约降至40 mL刻度线处
【易错警示】 该题易忽略进水量由试管中消耗的氧气的量决定,只关注空气中氧气的体积分数约为这一数值。130 mL空气中约含有26 mL 氧气,反应完毕且装置冷却至室温后,打开止水夹,试管内进水量约为26 mL,因此量筒中液面约降至24 mL刻度线处。
【解析】 最终量筒内液面约降至24 mL刻度线处。
3.[2019洛阳一模]某同学利用图甲所示装置测定空气中氧气的含量,其中燃烧匙内的白磷用电加热装置点燃,瓶内气压用气体压强传感器测定,其变化如图乙所示。则下列分析合理的是( ) 甲 乙A.t1 s后的一段时间能观察到白磷燃烧产生大量白色烟雾B.从瓶内气压达到最高值至t2 s,瓶内温度始终保持不变C.根据t2 s时瓶内的气压值,可以计算出氧气约占空气体积的百分比D.t3 s后的一段时间内瓶内气压又显著增加,原因是温度又升高了
【解析】 白磷燃烧产生大量白烟,不是烟雾,A错误。白磷燃烧放热,会使瓶内温度升高,燃烧结束,温度又慢慢恢复到室温,B错误。瓶内初始压强约为100 kPa,反应结束冷却到室温后瓶内压强约为80 kPa。瓶内压强减小的原因是瓶内的氧气被消耗了,故根据压强减少了约20 kPa,占瓶内初始压强的1/5,可以计算出氧气约占空气体积的百分比,C正确。t3 s时瓶内的压强又显著增加,是因为此时烧杯中的水被倒吸入瓶内,从而导致瓶内压强增大,D错误。
1.反应原理及制取装置
(1)发生装置及反应原理
高锰酸钾粉末进入导气管,堵塞导气管
可以通过控制液体的滴加速度来控制反应
巧记三种制取氧气的化学方程式3个反应均为分解反应,化学方程式中反应物的化学计量数都是“2”,反应条件:谁含“Mn”,不加“MnO2”,不含“Mn”加“MnO2”;固体要加热,液体不加热。
(4)操作步骤以加热高锰酸钾制取氧气为例:查、装、定、点、收、离、熄(谐音记为“茶庄定点收利息”)。①查:检查装置的气密性;②装:把药品装入试管内,使之平铺在试管底部;③定:把试管固定在铁架台上;④点:点燃酒精灯加热;⑤收:收集气体;⑥离:将导管撤离水槽;⑦熄:熄灭酒精灯。
先撤离导管后熄灭酒精灯,以防水倒吸使试管炸裂。
【反思设问】 加热高锰酸钾制取氧气时,实验结束后先熄灭酒精灯还是先撤离导管?为什么?
2.“多功能瓶”的应用
3.反应速率的控制或平稳气流的产生
下图是常见的气体制取装置(夹持装置已省略),实验室里用过氧化氢溶液制取氧气时,欲获得平稳的气流:
(1)若选用图1中的仪器a作为反应容器,下列操作能够获得平稳气流的是 (填序号)。 ①把二氧化锰缓慢投入盛有过氧化氢溶液的试管中②把过氧化氢溶液缓慢倒入盛有二氧化锰的试管中(2)图2中的气体发生装置简单、操作方便,但无法控制反应速率。为了获得平稳的氧气气流,应从图3中选取 (填字母)与图1中的a组装成新的气体发生装置。 (3)在连接图1中的b和d时,使d较易插入b中的措施是 。
将伸入橡皮管的导管一端用水润湿
某兴趣小组用微型实验探究燃烧的条件,如图所示。
(1)请写出滴管中的液体滴入单球管中时发生反应的化学方程式。 2H2O2 2H2O+ O2↑(2)将制得的气体收集在集气管中,用弹簧夹夹紧胶皮管,将红磷在酒精灯上点燃,迅速放进集气管中,并塞紧橡皮塞,观察到的现象是什么?答:红磷燃烧,产生大量白烟,气球先胀大后变瘪。
5.向上排空气法和排水法哪种方法收集的氧气更纯净?
为了得到上述问题的答案,某兴趣小组同学做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,并使用传感器测定收集到的氧气浓度,数据见下表。
(1)小柯用向上排空气法收集氧气时,以能使放置在集气瓶瓶口带火星的木条复燃为氧气集满的标准;用排水法收集氧气时,以观察到 为氧气集满的标准。 (2)以上两种方法中, 法收集到的氧气更纯净。(3)请分析用向上排空气法收集到的氧气浓度接近80%的原因。
集气瓶中的水排尽,且瓶口有大气泡冒出
当观察到带火星的木条复燃时,集气瓶内还有空气(或因为氧气的密度略大于空气的密度,所以难以将瓶内的空气排尽等,合理即可)。
1.[2020湖北恩施州]如图是实验室制取气体的发生装置和收集装置。请回答下列问题:
A B C
D E F
(1)指出图中标有数字②的仪器名称: 。 (2)实验室常用装置BD制取的气体有 (用化学式表示,任写一种),其原理用化学方程式表示为 。 (3)实验室里用氯化铵固体和氢氧化钙固体混合加热制取NH3。用该法制取NH3时,其发生装置应选用装置 ,其收集装置若选择用F这种可用于集气、洗气等的多功能装置,则气体应从 (填“a”或“b”)端进入F中。
O2(或H2,合理即可)
2H2O2 2H2O+O2↑(或Zn+H2SO4 ZnSO4+H2↑,与上一空对应)
2.[2020湖南邵阳改编]根据下列装置,结合所学化学知识,回答下列问题:
(1)A图中仪器①的名称是 。 (2)实验室制取并收集较纯净的氧气,小华同学已选用A装置作为发生装置,则他还需要选择的装置或仪器有 (填装置序号),该反应的化学方程式是 。小华利用上述收集方法收集到的氧气不纯,原因可能是 (任写出一点)。
(3)实验室利用硫化亚铁固体和稀硫酸混合制取硫化氢气体,通常选择的发生装置是 (填装置序号)。这个反应属于复分解反应,对应的化学方程式是 。
导管口一有气泡冒出就开始收集了(合理即可)
FeS+H2SO4 FeSO4+ H2S↑
2KClO3 2KCl+3O2↑
3.[2021预测]实验室用下图所示装置制取氧气并完成相关实验(夹持仪器已略去)。
(1)仪器①的名称是 。 (2)用C装置收集气体的方法是 (填选项字母)。 a.排水法 b.向下排空气法c.向上排空气法(3)检验C中收集满氧气的方法是 。
(4)C中收集满氧气后,打开弹簧夹K1、K4,关闭K2、K3,其中打开K1的目的是 .. 。点燃D中燃烧匙内的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是 。待红磷熄灭、C装置冷却后,打开K3,观察到的现象是 。
将带火星的木条靠近C装置上端瓶口,木条复燃
排出A中继续产生的气体,防止锥形瓶内气压过大
放出热量,产生大量白烟
烧杯B中的水进入C装置
【解析】 (2)用C装置收集气体时,气体从下端进入,空气从上端排出,是用向上排空气法收集氧气。(4)关闭K2后,打开K1的目的是排出锥形瓶内继续产生的气体,防止气压过大;红磷燃烧消耗氧气,导致C装置中的气压减小,打开K3后,烧杯B中的水会进入C装置。
以O2为核心的物质转化关系构建
1.写出下列物质的化学式:a ,b ,c 。 2.写出图中涉及的化学方程式:① .② .③ .④ .⑤ .⑥ .⑦ .⑧ .
相关课件
这是一份中考化学一轮单元总复习课件 第二单元 我们周围的空气 (含答案),共60页。PPT课件主要包含了核心知识·建构脉络图,主干回顾·厚积知识力,78%,保护气,21%,供给呼吸,支持燃烧,电光源,氧气的制取,沸点不同等内容,欢迎下载使用。
这是一份中考化学一轮单元总复习课件 第二单元 我们周围的空气 (含答案),共60页。PPT课件主要包含了核心知识·建构脉络图,主干回顾·厚积知识力,78%,保护气,21%,供给呼吸,支持燃烧,电光源,氧气的制取,沸点不同等内容,欢迎下载使用。
这是一份中考总复习化学(河南地区)18.题型六 化学实验课件,共32页。PPT课件主要包含了目录河南·中考,实验方案的设计与评价,类型1,思路分析,微型实验,类型2,数字化实验,类型3,提分技法,与压强有关的实验等内容,欢迎下载使用。












