



中考总复习化学(河南地区)14.题型二 坐标曲线课件
展开一、溶液pH的变化曲线二、反应物质量的变化曲线三、生成物质量的变化曲线四、金属与酸反应的曲线(详见微专项6)五、金属与盐溶液反应后溶液和固体的质量变化曲线六、与CaO相关的质量变化曲线七、与催化剂相关的变化图像八、有关化学反应速率的曲线
1.溶液的稀释(1)稀释碱性溶液,溶液的pH由 7的某个数值开始逐渐 ,但溶液始终呈 性,溶液的pH不会 7。 (2)稀释中性溶液,溶液的pH 7。 (3)稀释酸性溶液,溶液的pH由 7的某个数值开始逐渐 ,但溶液始终呈 性,溶液的pH不会 7。
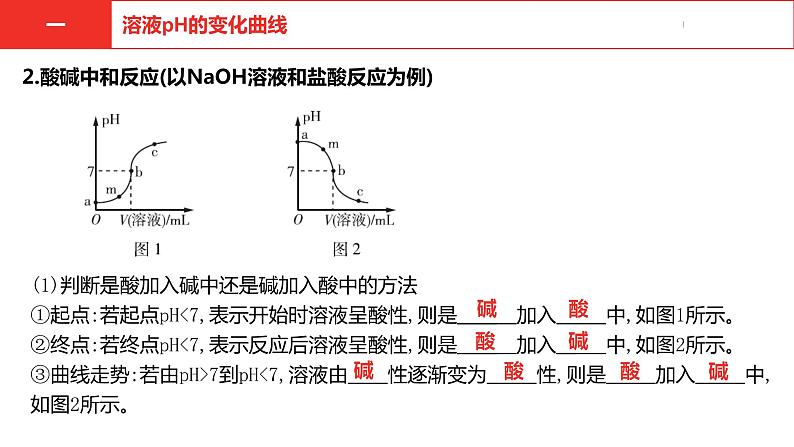
(1)判断是酸加入碱中还是碱加入酸中的方法①起点:若起点pH<7,表示开始时溶液呈酸性,则是 加入 中,如图1所示。 ②终点:若终点pH<7,表示反应后溶液呈酸性,则是 加入 中,如图2所示。 ③曲线走势:若由pH>7到pH<7,溶液由 性逐渐变为 性,则是 加入 中,如图2所示。
2.酸碱中和反应(以NaOH溶液和盐酸反应为例)
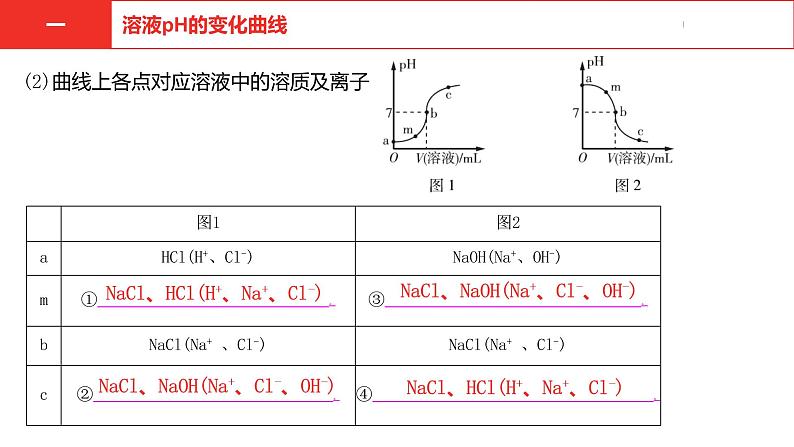
NaCl、HCl(H+、Na+、Cl-)
NaCl、NaOH(Na+、Cl-、OH-)
NaCl、NaOH(Na+、Cl-、OH-)
(2)曲线上各点对应溶液中的溶质及离子
3.向盐酸和CaCl2的混合溶液中加入Na2CO3溶液溶液的pH变化如图所示:分析:发生的化学反应可能有:Na2CO3+2HCl NaCl+CO2↑+H2O、Na2CO3+CaCl2 CaCO3↓+2NaCl、CaCO3+2HCl CaCl2+CO2↑+H2O,因中间产物CaCO3不能在盐酸中沉淀,所以Na2CO3先与HCl反应(AB段),后与CaCl2反应(BC段),CD段Na2CO3过量。(1)AB段:溶液的pH逐渐 ,B点时, 反应完全,溶液的pH 7。 (2)BC段:碳酸钠溶液与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液的pH , 点时,氯化钙反应完全。 (3)CD段:碳酸钠溶液过量,溶液显 性,随着碳酸钠溶液的增加,溶液的pH逐渐 。
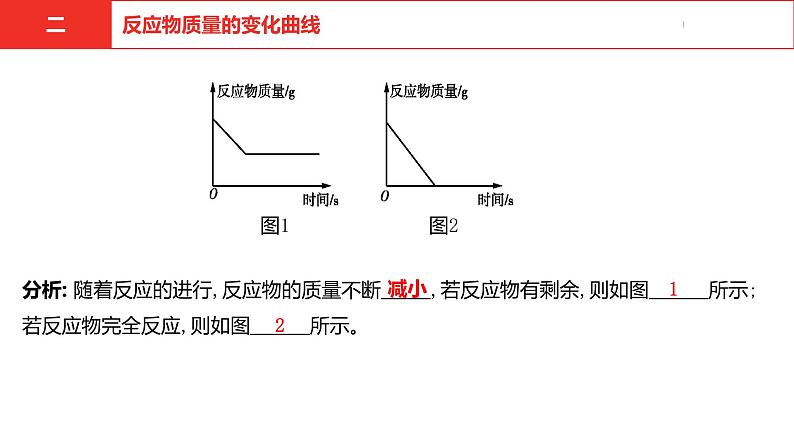
图1 图2分析: 随着反应的进行,反应物的质量不断 ,若反应物有剩余,则如图 所示;若反应物完全反应,则如图 所示。
2.一种物质和多种物质反应(遵循优先反应原则)分析:(1)第一个反应的生成物从反应一开始就立即产生,随着反应的进行,生成物的质量不断 ,完全反应后质量达到最 并保持不变,如图 所示。 (2)第二个反应在第一个反应结束后才开始,即起点的横坐标 (填“是”或“不是”)0,随着反应的进行,生成物的质量不断 ,完全反应后质量达到最 并保持不变,如图 所示。
图 1 图 2 1.一种物质和另一种物质反应分析: 开始时,生成物的质量为0,即起点为0。随着反应的进行,生成物的质量不断 ,反应结束后生成物的质量达到最大并保持不变,如图 所示。
(1)H+优先与OH-反应(或OH-优先与H+反应)举例1:向一定量CuSO4和H2SO4的混合溶液中加入NaOH溶液先: ; (写化学方程式,下同)后: 。 点拨:不溶性碱[Cu(OH)2、Mg(OH)2]不能在酸中沉淀。举例2:向一定量NaOH和Na2CO3的混合溶液中加入稀盐酸先: ; 后: 。 点拨:酸性气体不能在碱的溶液中逸出。
2NaOH+H2SO4 Na2SO4+2H2O
NaOH+HCl NaCl+H2O
CuSO4+2NaOH Cu(OH)2↓+Na2SO4
Na2CO3+2HCl 2NaCl+CO2↑+H2O
分析:向Na2CO3和NaOH的混合溶液中滴加稀盐酸时,稀盐酸先和NaOH发生中和反应,当NaOH完全反应后,稀盐酸才和Na2CO3反应放出CO2气体,生成气体的质量的变化曲线如图2所示。
(2)CO32- 优先与H+反应举例:向一定量的氯化钙和稀盐酸的混合溶液中滴加Na2CO3溶液先: ; 后: 。 分析:向CaCl2和稀盐酸的混合溶液中滴加Na2CO3溶液时,Na2CO3先和稀盐酸反应放出CO2气体,生成气体的质量变化曲线如图1所示;当稀盐酸完全反应后,Na2CO3才与CaCl2溶液反应生成沉淀,生成沉淀的质量变化曲线如图2所示。
Na2CO3+CaCl2 CaCO3↓+2NaCl
举例:(1)Zn+2AgNO3 Zn(NO3)2+2Ag 65 340 189 216反应后溶液质量减小,固体质量增加,整体遵守质量守恒定律,变化趋势如图1所示;(2)Zn+Cu(NO3)2 Zn(NO3)2+Cu 65 188 189 64反应后溶液质量增加,固体质量减小,整体遵守质量守恒定律,变化趋势如图2所示。
金属与盐溶液反应后溶液和固体的质量变化曲线
图1 图2
与CaO相关的质量变化曲线
1.横轴是氧化钙的质量(不考虑溶解放热引起的温度变化)
向一定量饱和石灰水中加入一定量生石灰。(考虑温度变化)
分析:恢复到室温后,溶剂质量变小、溶质质量变小、溶液质量变小、溶解度和溶质质量分数不变。
与催化剂相关的变化图像
催化剂在化学反应前后只起改变反应速率的作用,其质量在化学反应前后不发生变化(如图1所示),且用不用催化剂生成物的质量不受影响(如图2所示)。如用过氧化氢溶液和二氧化锰制取氧气时,二氧化锰是催化剂,其质量在反应前后不变,能加快反应速率,但生成氧气的质量不变。
有关化学反应速率的曲线
化学反应速率与反应物的接触面积和反应物的浓度有关。反应物的接触面积越大,反应速率越快;反应物的浓度越大,反应速率越快。但生成物的质量只与反应物的质量有关,与反应物的状态和接触面积无关。以等质量的块状、粉末状石灰石与稀盐酸的反应为例(如图3所示),粉末状石灰石与稀盐酸的反应速率较快,但最终生成CO2的质量相等。
例 [2021预测]下列图像分别与选项中的操作相对应,其中合理的是( ) A.向一定量的氢氧化钠溶液中加水 B.向一定量的硫酸铜溶液中加入一定量的铁粉 C.向一定量的二氧化锰固体中加入一定量的过氧化氢溶液 D.向一定量的硫酸和硫酸铜混合溶液中滴加氢氧化钠溶液
【思路分析】 氢氧化钠溶液呈碱性,随着水的加入,溶液的pH逐渐减小,但溶液始终呈碱性,pH不可能减小到7,更不可能小于7;硫酸铜溶液和铁反应,每160份质量的硫酸铜参加反应生成152份质量的硫酸亚铁,反应后溶液质量减小,反应结束后,溶液质量不再变化;向二氧化锰固体中加入过氧化氢溶液,随着反应的进行,催化剂二氧化锰的质量不变且无固体物质生成,固体质量不改变;向一定量的硫酸和硫酸铜的混合溶液中滴加氢氧化钠溶液,氢氧化钠优先与硫酸反应,反应过程中无沉淀生成,当硫酸反应完全后,氢氧化钠才与硫酸铜反应生成氢氧化铜沉淀,故反应一开始无沉淀生成。
1.[2020河南省实验二模]下列图像能正确反映其对应关系的是( ) A.加热一定量氯酸钾和二氧化锰的混合物 B.向一定量氢氧化钠和硝酸钡的混合溶液中滴加稀硫酸 C.一定质量的镁条在空气中燃烧 D.高温加热一定量碳和氧化铁的混合物
2.[2020安阳一模]下列图像分别与选项中的操作相对应,其中合理的是( ) A.加热一定质量的高锰酸钾固体 B.等质量的镁粉、铝粉与足量的稀盐酸反应 C.温度不变,向一定质量的饱和氢氧化钙溶液中加入氧化钙 D.向一定量稀盐酸和氯化钡的混合溶液中滴加碳酸钠溶液
中考化学复习题型突破二坐标曲线题练习课件: 这是一份中考化学复习题型突破二坐标曲线题练习课件,共38页。PPT课件主要包含了正确答案C等内容,欢迎下载使用。
人教版中考化学题型突破二坐标曲线题作业课件: 这是一份人教版中考化学题型突破二坐标曲线题作业课件,共49页。PPT课件主要包含了答案是C,答案是D,答案是A等内容,欢迎下载使用。
中考总复习化学(河南地区)19.题型七 知识的迁移和应用课件: 这是一份中考总复习化学(河南地区)19.题型七 知识的迁移和应用课件,共17页。PPT课件主要包含了目录河南·中考,热点信息题,Ca2+和Cl-,过氧化物,知识的迁移和应用,题型七,提分特训,天然气,∶21,纸条变蓝色等内容,欢迎下载使用。












