
所属成套资源:高考化学必背知识与解题秘籍手册
高考化学必背知识与解题秘籍手册模块1.3 物质结构 元素周期律
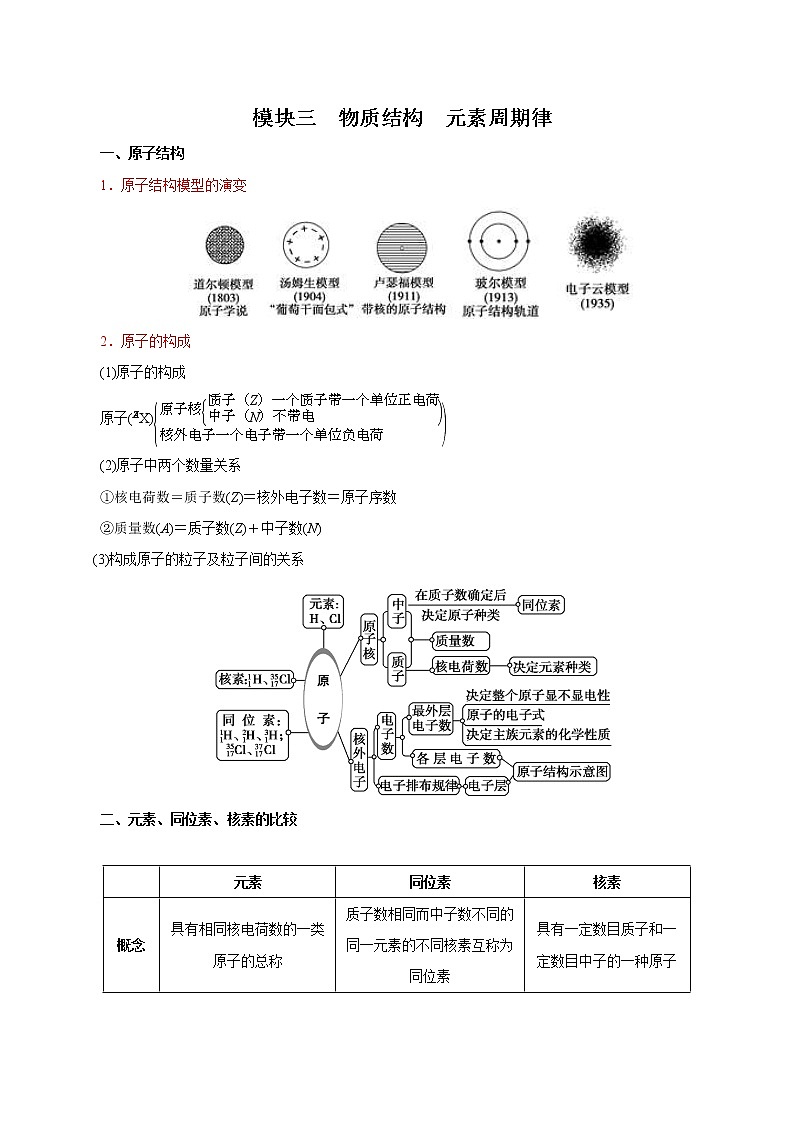
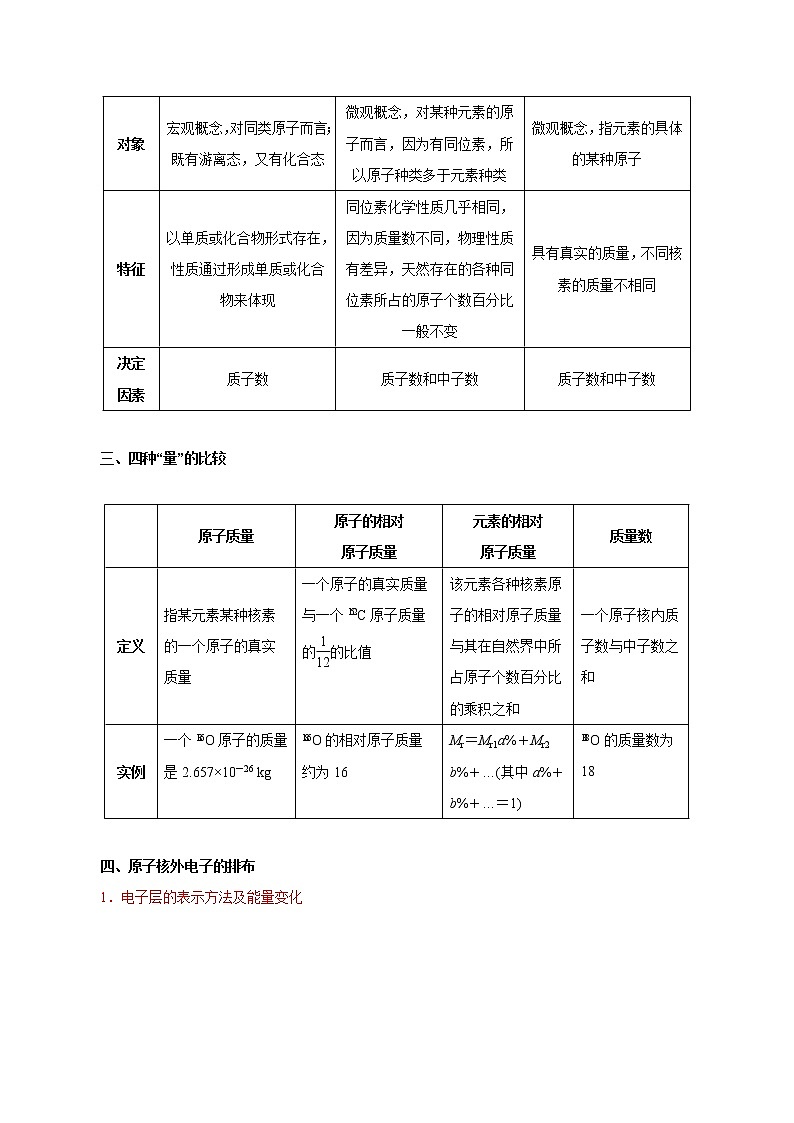
展开模块三 物质结构 元素周期律一、原子结构1.原子结构模型的演变2.原子的构成(1)原子的构成原子(X)(2)原子中两个数量关系①核电荷数=质子数(Z)=核外电子数=原子序数②质量数(A)=质子数(Z)+中子数(N)(3)构成原子的粒子及粒子间的关系二、元素、同位素、核素的比较 元素同位素核素概念具有相同核电荷数的一类原子的总称质子数相同而中子数不同的同一元素的不同核素互称为同位素具有一定数目质子和一定数目中子的一种原子对象宏观概念,对同类原子而言;既有游离态,又有化合态微观概念,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类微观概念,指元素的具体的某种原子特征以单质或化合物形式存在,性质通过形成单质或化合物来体现同位素化学性质几乎相同,因为质量数不同,物理性质有差异,天然存在的各种同位素所占的原子个数百分比一般不变具有真实的质量,不同核素的质量不相同决定因素质子数质子数和中子数质子数和中子数 三、四种“量”的比较 原子质量原子的相对原子质量元素的相对原子质量质量数定义指某元素某种核素的一个原子的真实质量一个原子的真实质量与一个C原子质量的的比值该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和一个原子核内质子数与中子数之和实例一个O原子的质量是2.657×10-26 kgO的相对原子质量约为16Mr=Mr1a%+Mr2 b%+…(其中a%+b%+…=1)O的质量数为18 四、原子核外电子的排布1.电子层的表示方法及能量变化2.原子核外电子排布规律3.原子核外电子排布的表示方法——原子或离子结构示意图(1~18号元素原子结构)如(1)Na的原子结构示意图:(2)Na+的离子结构示意图:五、元素金属性、非金属性强弱比较 金属性比较本质原子越易失电子,金属性越强判断依据①在金属活动性顺序中位置越靠前,金属性越强②单质与水或非氧化性酸反应越剧烈,金属性越强③单质还原性越强或离子氧化性越弱,金属性越强④最高价氧化物对应水化物的碱性越强,金属性越强⑤若Xn++Y―→X+Ym+,则Y金属性比X强非金属性比较本质原子越易得电子,非金属性越强判断依据①与H2化合越容易,气态氢化物越稳定,非金属性越强②单质氧化性越强,阴离子还原性越弱,非金属性越强③最高价氧化物对应水化物的酸性越强,非金属性越强④An-+B―→Bm-+A,则B非金属性比A强【温馨提醒】⑴比较物质非金属性强弱时,应是最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。⑵所含元素种类最多的族是ⅢB族,形成化合物种类最多的元素在第ⅣA族。⑶化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。⑷并非所有非金属元素的氢化物分子间都存在氢键,常见的只有非金属性较强的元素如N、O、F的氢化物分子间可形成氢键。⑸金属性是指金属气态原子失电子能力的性质,金属活动性是指在水溶液中,金属原子失去电子能力的性质,二者顺序基本一致,仅极少数例外。如金属性Pb>Sn,而金属活动性Sn>Pb。⑹利用原电池原理比较元素金属性时,不要忽视介质对电极反应的影响。如Al—Mg—NaOH溶液构成原电池时,Al为负极,Mg为正极;Fe—Cu—HNO3(浓)构成原电池时,Cu为负极,Fe为正极。六、元素周期表1.元素周期表的结构(1)周期 短周期长周期序号1234567元素种数288181832不完全周期,最多容纳32种元素,目前排了26种元素0族元素原子序数21018365486 (2)族①主族:由短周期元素和长周期元素共同组成的族(第18列除外) 列序121314151617主族序数ⅠAⅡAⅢAⅣAⅤAⅥAⅦA ②副族:仅由长周期元素组成的族(第8、9、10列除外) 列序345671112族序数ⅢBⅣBⅤBⅥBⅦBⅠBⅡB ③Ⅷ族:包括8、9、10三个纵列。④0族:第18纵列,该族元素又称为稀有气体元素。2.元素周期表中的特殊位置(1)分区①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。(2)过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。(3)镧系:元素周期表第6周期中,57号元素镧到71号元素镥共15种元素。(4)锕系:元素周期表第7周期中,89号元素锕到103号元素铹共15种元素。(5)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。3.“位、构、性”三者之间的关系4.元素周期表中的几个特殊“数字”(1)含元素种数最多的周期是第6周期,有32种元素;含元素种类最多的族是ⅢB族,共有32种元素。(2)过渡元素包括7个副族和第Ⅷ族,全部都是金属元素,原子最外层电子数不超过2个(1~2个)。(3)最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。(4)同一周期ⅡA族与ⅢA族的原子序数可能相差1(2、3周期)或11(4、5周期)或25(6、7周期)。(5)主族的族序数=最外层电子数=最高正价=8-|最低负价|5.元素周期表的应用预测新元素,探索新材料,合成新物质(1)在金属元素和非金属元素的交界处寻找半导体材料。(2)在过渡金属元素中寻找催化剂,并通过加入少量稀土元素改善性能。(3)在ⅣB到ⅥB族的过渡金属元素中寻找耐高温、耐腐蚀的材料,用以制造火箭、导弹、宇宙飞船等。(4)利用元素周期表,还可以寻找合适的超导材料、磁性材料等。(5)研究元素周期表右上角的元素,合成新农药。6.元素周期表中的规律(1)电子排布规律最外层电子数为1或2的原子可以是ⅠA族、ⅡA族或副族元素的原子;最外层电子数是3~7的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。(2)序数差规律①同周期相邻主族元素原子的“序数差”规律a.除第ⅡA族和第ⅢA族外,其余同周期相邻元素序数差为1。b.同周期第ⅡA族和第ⅢA族为相邻元素,其原子序数差为第二、三周期时相差1,第四、五周期时相差11,第六、七周期时相差25。②同主族相邻元素的“序数差”规律a.第二、三周期的同族元素原子序数相差8。b.第三、四周期的同族元素原子序数相差有两种情况:第ⅠA族、ⅡA族相差8,其他族相差18。c.第四、五周期的同族元素原子序数相差18。d.第五、六周期的同族元素原子序数镧系之前的相差18,镧系之后的相差32。e.第六、七周期的同族元素原子序数相差32。(3)奇偶差规律元素的原子序数与该元素在周期表中的族序数和该元素的主要化合价的奇偶性一致。若原子序数为奇数时,主族族序数、元素的主要化合价均为奇数,反之则均为偶数(N、Cl元素除外,N元素有多种价态,Cl元素也有ClO2)。0族元素的原子序数为偶数,其化合价看作0。七、化学键与分子间作用力 化学键分子间作用力概念物质中直接相邻原子或离子之间存在的强烈的相互作用分子间存在着将分子聚集在一起的作用力存在原子与原子间或阴、阳离子间分子与分子间强弱强弱影响物理性质或化学性质物理性质(如熔点、沸点、溶解度等)类型常见有离子键、共价键 八、离子键、共价键的概念和成因 离子键共价键概念阴、阳离子间强烈的相互作用原子间通过共用电子对所形成强烈的相互作用成键微粒阴、阳离子原子形成条件活泼的金属与活泼的非金属之间非金属元素原子之间存在只存在于离子化合物中,如NaCl、NaOH、NH4Cl、Na2O2中 (1)共价化合物如H2O、SiO2、NH3、HClO,(2)大部分有机化合物中(除羧酸盐外),(3)离子化合物中如NaOH、NH4Cl、Na2O2,(4)共价单质中 九、离子化合物、共价化合物 化合物类型定义与物质分类的关系举例离子化合物含有离子键的化合物包括强碱、绝大多数盐及活泼金属的氧化物和过氧化物NaCl、Na2O2、NaOH、Na2O、NH4Cl等共价化合物只含有共价键的化合物包括酸、弱碱、极少数盐、气态氢化物、非金属氧化物、大多数有机物等H2S、SO2、CH3COOH、H2SO4、NH3·H2O等 十、常见化合物的电子式十一、巧记10e-、18e-微粒10电子体和18电子体是元素推断题的重要突破口。以Ne为中心记忆10电子体:以Ar为中心记忆18电子体:此外,由10电子体中的CH4、NH3、H2O、HF失去一个H剩余部分—CH3、—NH2、—OH、—F为9电子体,两两组合得到的物质如CH3CH3、CH3OH、H2O2、N2H4、F2等也为18电子体。十二、简单共价化合物的结构模型、结构式 物质HClCl2H2ONH3CH4电子式结构式H—ClCl—ClH—O—H球棍模型比例模型 十三、离子晶体、分子晶体、原子晶体、金属晶体的形成方式 晶体类型离子晶体分子晶体原子晶体金属晶体构成微粒阴、阳离子分子原子金属阳离子和自由电子微粒间作用力离子键分子间作用力共价键金属键形成方式阴、阳离子通过离子键按一定的方式有规则排列分子间依靠分子间作用力按一定规则排列原子通过共价键结合成空间网状结构金属阳离子和自由电子通过金属键紧密堆积而成实例NaCl、CaO、NaOH冰、干冰、HCl(固体)金刚石、SiO2、硅镁、铝、铁 十四、常见晶体中微粒的空间排列方式及相互作用力




