





高考化学二轮复习专题1化学基本概念(含解析)课件PPT
展开01 化学计量及其应用
03 离 子 反 应
一、阿伏加德罗常数1.判断有关阿伏加德罗常数题正误的“三大步骤”第一步:查看物质的状态及所处状况——正确运用气体摩尔体积的前提。第二步:分析题干所给物理量与物质的量的关系——正确进行换算的前提。第三步:把握物质的微观结构和物质变化过程中微粒数目的变化——正确判断微粒数目的前提。
2.主要方法(1)抓“两看”,突破“状态、状况”陷阱一看“气体”是否处于“标准状况”。二看“标准状况”下,物质是否为“气体”(如CCl4、H2O、Br2、SO3、酒精、己烷、苯等在标准状况下均不是气体)。(2)排“干扰”,突破“质量、状况”陷阱给出非标准状况下气体的物质的量或质量,干扰学生正确判断,误以为无法求解物质所含的粒子数,实际上,此时物质所含的粒子数与温度、压强等外界条件无关。(3)记“组成”,突破“结构”判断陷阱①记特殊微粒中质子、中子或电子的数目,如Ne、D2O、18O2、—OH、OH-等。②记实验式相同的物质,如NO2和N2O4、乙烯(C2H4)和丙烯(C3H6)等。
③记摩尔质量相同的物质,如N2、CO、C2H4等。④记特殊物质的摩尔质量,如D2O、18O2、H37Cl等。(4)审“要求”,突破“离子数目”判断陷阱一审是否有弱酸或弱碱离子的水解。二审是否指明了溶液的体积。三审所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液中,c(H+)=0.1 ml·L-1,与电解质的组成无关;0.05 ml·L-1的Ba(OH)2溶液中,c(OH-)=0.1 ml·L-1,与电解质的组成有关。(5)记“隐含反应”,突破“粒子组成、电子转移”判断陷阱注意可逆反应,如1 ml N2和3 ml H2在一定条件下充分反应后,生成NH3的分子数应小于2NA。再如弱电解质中存在电离平衡,不能完全电离等。
(6)“分类”比较,突破“电子转移”判断陷阱①同一种物质在不同反应中作氧化剂还是还原剂的判断。如Cl2和Fe或Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。再如Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反应,Na2O2只作氧化剂。②量不同,生成物中元素所表现的化合价不同。如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。③氧化剂或还原剂不同,生成物中元素所表现的化合价不同。如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。④注意氧化还原的顺序。如向FeI2溶液中通入Cl2,先氧化I-,再氧化Fe2+。
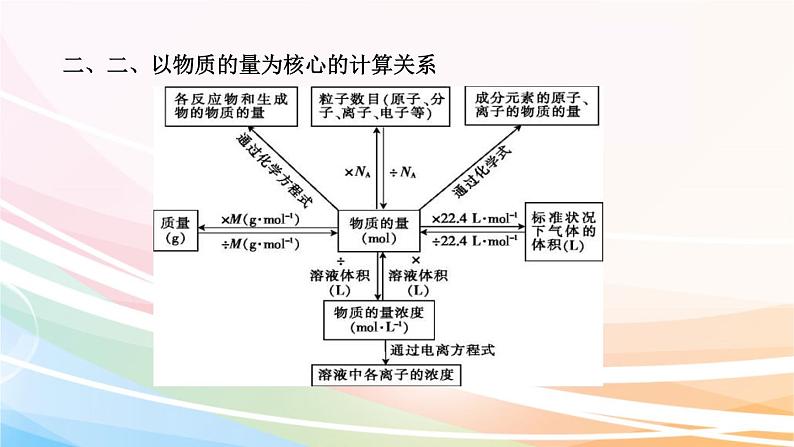
二、二、以物质的量为核心的计算关系
1.已知NA是阿伏加德罗常数的值。下列说法错误的是( )。A.1 ml 3He含有的质子数为2NAB.500 mL 2 ml·L-1 FeCl3溶液中Cl-数目为3NA,且 =3C.1 ml Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为2NAD.1 ml某烷烃CnH2n+2(n≥1)分子中含有的共价键数目为(3n+1)NA
解析▶ 3He的原子序数为2,质子数为2,则1 ml 3He含有的质子数为2NA,A项正确;Fe3+为弱碱阳离子,在水溶液中部分发生水解,所以500 mL 2 ml·L-1 FeCl3溶液中Fe3+的物质的量小于1 ml, >3,B项错误;无论是生成MgO还是Mg3N2,镁元素的化合价均由0价升高到+2价,1 ml Mg失2 ml 电子,转移的电子数目为N2A,C项正确;1 ml CnH2n+2(烷烃)中含有(n-1) ml 碳碳单键和(2n+2) ml 碳氢键,总共含有(3n+1) ml共价键,含有的共价键数目为(3n+1)NA,D项正确。
2.国际计量大会第26 届会议新修订了阿伏加德罗常数,阿伏加德罗常数有了准确值:6.02214076×1023 ml-1, 并于2019 年 5月20 日正式生效。NA为阿伏加德罗常数的值。下列说法正确的是( )。A.常温常压下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NAB.64 g SO2与足量的O2在一定条件下反应生成的SO3分子数目为NAC.常温下,pH=12的碳酸钠溶液中含OH-的数目为 L 1 ml·L-1 Na2S溶液中S2-与HS-总数为0.1NA
解析▶ 乙烯和丙烯的实验式为CH2,常温常压下,42.0 g乙烯和丙烯的混合气体含3 ml CH2,所以含有的碳原子数为3NA,A项正确;该反应为可逆反应,不可进行到底,所以生成的SO3分子数目小于NA,B项错误;溶液的体积未知,无法计算溶液中的微粒数目,C项错误;Na2S的物质的量为0.1 ml,含硫元素的粒子的物质的量为0.1 ml,S元素以S2-、HS-、H2S三种形式存在,所以S2-与HS-总数小于0. 1NA,D项错误。
1.已知NA是阿伏加德罗常数的值。下列说法错误的是( )。A.标准状况下,11.2 L 12C18O中含有的中子数为8NAB.25 ℃时,500 mL pH=11的碳酸钠溶液中,由水电离出的OH-数目为 L 2 ml·L-1 NaHCO3溶液中HCO3-和CO32-的数目之和为0.2NAD.1 ml SiO2晶体中,含有Si—O键的数目为4NA
解析▶ 每个12C18O分子含有6+10=16个中子,故标准状况下,11.2 L (0.5 ml) 12C18O中共含有8NA个中子,A项正确;25 ℃时,pH=11,c(OH)-=0.001 ml·L-1,OH-全部来自水的电离,故500 mL此溶液中由水电离出的OH-数目为0.000N5A,B项正确;HCO3-既能电离为CO32-,又能水解为H2CO3,0.10 L 2 ml·L-1 NaHCO3溶液中HCO3-和CO32-的数目之和小于0. 2NA,C项错误;由SiO2的结构可知,1 ml SiO2晶体中,含有Si—O键的数目为4NA,D项正确。
2.设NA为阿伏加德罗常数的值。下列说法正确的是( )。A.100 g 46%的乙醇水溶液中,含O—H键的数目大于 L Cl2完全与CH4发生取代反应,生成的HCl数目为0.1NAC.常温下,5.6 g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为的H3PO4溶液中,H+的数目为0.01NA
解析▶ 100 g 46%的乙醇水溶液中,含有1 ml乙醇、3 ml水,乙醇、水中均含O—H键,所以100 g 46%的乙醇水溶液中,含O—H键的数目大于NA,A项正确;未指明状态(温度和压强),2.24 L Cl2的物质的量无法确定,B项错误;常温下,铁在浓硝酸中发生钝化,无法计算转移的电子数目,C项错误;溶液体积未知,故此溶液中H+的个数无法计算,D项错误。
1.标准状况与常温、常压的难辨别性。只有气体体积才与温度、压强有关,而质量与温度、压强无关。关于气体与非气体的判断:标准状况下,无机物中常见的SO3、H2O、Br2等为非气体;一般来说,有机物中碳原子数4以内的烃为气体。2.物质组成的特殊性。常见特殊组成有如下几种情况:①有些物质实验式相同,如乙烯、丙烯等单烯烃,NO2与N2O4,O2与O3,淀粉与纤维素等;②有些物质中某元素的百分含量相等,如Cu2S和CuO中的Cu元素,甲苯与甘油中的氢元素,CaCO3和KHCO3中的碳元素等;③有些物质中阴、阳离子个数之比易混淆,如Na2O2中Na+与的个数之比为2∶1;④有些物质的摩尔质量相同,如N2与CO、C2H4等;⑤计算水溶液中氢、氧原子个数时,不能忽视水中的氢、氧原子。
3.化学反应的隐蔽性。首先注意有无隐含反应,如NO2和N2O4之间存在相互转化,合成氨反应属于可逆反应,定量浓硝酸与金属反应、定量浓硫酸与活泼金属反应等。4.电子转移数目的难判断性。对于有电子转移的化学反应,首先要写出化学方程式,其次用单线桥或双线桥法标出电子转移的方向和数目,最后注意是否是可逆反应,是否要进行过量计算。5.物质结构的复杂性。首先判断对物质结构的描述是否正确,最常见的是苯环中是否含有碳碳双键;其次要画出分子结构。6.电离与水解中概念的混淆性与数据的缺失性。弱电解质在水溶液中部分电离,可水解盐溶液中,离子发生微弱水解;求解溶液中离子的数目时,应注意浓度与体积数据是否齐全。
3.(2019年北京理综,26节选)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。Ⅰ.用已准确称量的KBrO3固体配制一定体积的a ml·L-1 KBrO3标准溶液;Ⅱ.取V1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;Ⅲ.向Ⅱ所得溶液中加入V2 mL废水; Ⅳ.向Ⅲ中加入过量KI;Ⅴ.用b ml·L-1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3 mL。已知:I2+2Na2S2O3 2NaI+Na2S4O6;Na2S2O3和Na2S4O6溶液颜色均为无色。废水中苯酚的含量为 g·L-1(苯酚摩尔质量:94 g·ml -1)。
4.(2019年陕西汉中二检)测定铁红产品纯度的方法:称取m g铁红,溶于一定量的硫酸中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c ml·L-1硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O32- S4O62-+2I-。平行滴定三次,平均消耗硫代硫酸钠标准液V mL。则铁红产品的纯度为 (用含有c、V、m的式子表示)。
3.(2019年山东菏泽第一次模拟节选)氮化铬(CrN)纯度的测定:制得的CrN中含有Cr2N杂质,取样品14.38 g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72 g,则样品中CrN与Cr2N的物质的量之比为 (已知Cr的相对原子质量为52)。
4.(2019年福建福州质检节选)为测定产物中Mg3N2的纯度,某小组称取4.0 g样品加入足量10% NaOH溶液中并加热,生成的气体全部用100.00 mL 0.500 ml·L-1硫酸吸收。将吸收后所得溶液稀释到250.00 mL,取25.00 mL该溶液,用0.2000 ml·L-1 NaOH标准溶液滴定过剩的硫酸。平行滴定三次,平均消耗NaOH溶液的体积为25.25 mL。样品中Mg3N2的质量分数为 (保留一位小数)。
1.明确一个中心必须以“物质的量”为中心——“见量化摩,遇问设摩”。2.注意三个守恒
3.明确两种方法(1)关系式法此法常用于多步连续反应的计算。确定关系式可利用各步反应的计量关系或某元素原子守恒关系,找出已知物质和未知物质的关系式,然后根据已知量和未知量列比例式求解。 (2)差量法①差量法的应用原理:差量法是指根据化学反应前后物质的量发生的变化,找出“理论差量”。这种差量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。用差量法解题的关键是把化学方程式中的对应差量(理论差量)及差量(实际差量)与未知量列成比例式,然后求解。②使用差量法时的注意事项a.所选差量要与未知量的数值成正比例或反比例关系。b.有关物质的物理量及其单位都要正确地使用和对应,即“上下一致,左右相当”。
一、基本概念有元素化合价升高的物质,失去电子,作还原剂,具有还原性,发生氧化反应,被氧化,对应的生成物是氧化产物;有元素化合价降低的物质,得到电子,作氧化剂,具有氧化性,发生还原反应,被还原,对应的生成物是还原产物。
一、常见的氧化剂和还原剂1.常见氧化剂及其还原产物
2.常见还原剂及其氧化产物
三、氧化还原反应的考查形式物质间的反应大多数是氧化还原反应,氧化还原反应的有关规律及基本概念在工农业生产、日常生活及科学研究中有非常重要的应用,与很多知识综合皆可构成新颖命题。备考时要注意以下常见的考查形式:
(1)基本概念的直接考查。这类题型主要有氧化还原反应类型的判断、指出氧化剂和还原剂、氧化产物和还原产物及它们之间的定量关系。(2)判断微粒的氧化性或还原性的强弱。(3)配平氧化还原反应方程式,尤其是新情境下的氧化还原反应方程式的书写。(4)关于氧化还原反应的化学计算。例如,利用氧化还原反应滴定原理测定物质的组成等计算。(5)离子反应中氧化还原反应的考查。(6)以电化学知识为载体的综合考查。原电池原理与电解原理的实质都是发生氧化还原反应,反应原理及计算仍符合氧化还原反应规律。
1.完成下列各小题:(1)用铅矿石(主要成分为PbS)冶炼铅的主要反应有2PbS+3O2 2PbO+2SO2(反应a)和PbS+2PbO 3Pb+SO2(反应b),反应a中的氧化剂是 (填化学式);反应b中氧化产物和还原产物的物质的量之比为 。
(2)某工厂焙烧硫化铜矿石(含 CuFeS2、Cu2S等)的工艺流程如下:炉气中的有害气体成分是 ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为 。 (3)某烟气中的NO2与尿素[CO(NH2)2](C元素的化合价为+4价)反应进行脱硝。反应的化学方程式为2CO(NH2)2+4NO2 4H2O+2CO2+4N2+O2。该反应的氧化产物为 ,若反应过程中有0.15 ml NO2反应,则转移的电子数为 。
解析▶ (1)反应a,氧气中的O元素化合价降低,为氧化剂;反应b,S元素化合价升高,Pb元素化合价降低,氧化产物为SO2,还原产物为Pb,氧化产物和还原产物的物质的量之比为1∶3。(2)金属硫化物焙烧时转化为金属氧化物与SO2,故炉气中的有害气体成分是SO2;Cu2S与O2反应时,氧化剂为O2,还原剂为Cu2S,根据得失电子守恒和原子守恒,二者的物质的量之比为2∶1。(3)脱硝反应中化合价升高的元素有两种:一种是氧元素,化合价从-2价升高到0价,生成氧气,另一种是CO(NH2)2中氮元素,化合价从-3价升高到0价,生成N2,因此氧化产物为 N2和O2;根据化合价变化情况可知4NO2~16e-,因此吸收0.15 ml NO2转移的电子数为0.15 ml×4NA ml-1=0.6NA。
1.完成下列各小题:(1)反应8NH3+3Cl2 N2+6NH4Cl中被氧化的NH3与被还原的Cl2的物质的量之比为 。 (2)反应2LiOH+6H2C2O4+2FePO4 2LiFePO4+7CO2↑+5X↑+7H2O中X的化学式为 ;每生成1 ml LiFePO4,该反应转移 ml e-。 (3)聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。该反应的氧化剂是 ,每生成1 ml [Fe(OH)SO4]n消耗 ml KClO3。
2.(2019年四川绵阳二诊)二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性。ClO2的制备及性质探究如图所示,回答下列问题:(1)装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为 。装置D中滴有几滴淀粉溶液,其作用是 。 (2)装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
SO2+H2SO4+2KClO3 2KHSO4+2ClO2
检验ClO2是否具有氧化性
解析▶ (1)装置C用于制备ClO2,同时还生成一种酸式盐,根据元素守恒可知,生成的酸式盐为KHSO4,该反应的化学方程式为SO2+H2SO4+2KClO3 2KHSO4+2ClO2;淀粉遇碘单质溶液变为蓝色,根据淀粉溶液是否变色,来判断溶液中是否有I2单质生成,从而检验ClO2是否具有氧化性。(2)装置E中反应的化学方程式为H2O2+2ClO2+2NaOH 2NaClO2+O2+2H2O,在该反应中ClO2是氧化剂,NaClO2是还原产物,H2O2是还原剂,O2是氧化产物,反应中氧化剂与还原剂的物质的量之比为2∶1。
1.守恒规律(1)原子守恒:反应前后原子的种类及数目均不变。(2)得失电子守恒:氧化剂得电子总数与还原剂失电子总数相等,或氧化剂化合价下降总数与还原剂化合价上升总数相等。2.根据氧化还原反应判断物质氧化性、还原性的相对强弱氧化性:氧化剂>氧化产物,氧化剂>还原剂;还原性:还原剂>还原产物,还原剂>氧化剂。3.准确把握不同反应介质中物质的存在形式或产物的价态(1)碱性介质中不能产生酸性物质,酸性介质中不能产生碱性物质;强氧化性环境中不能产生还原性物质,强还原性环境中不能产生氧化性物质。(2)KMnO4在酸性条件下的还原产物为Mn2+,在中性条件下的还原产物为MnO2,在碱性条件下的还原产物为MnO42-;H2O2在强氧化性环境下产生O2,在强还原性环境下生成OH-或H2O。
2.配平下列方程式。(1)潮湿的CuCl在空气中被氧化的化学方程式: CuCl+ O2+ 3CuO·CuCl2·3H2O+ HCl。 (2)工业上可用电解法处理含氰电镀废水(pH=10)。阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式: CN-+ ClO-+ CO32-+ N2↑+ + 。 (3)K2FeO4在H2SO4溶液中反应的离子方程式: FeO42-+ H+ O2↑+ Fe3++ 。
解析▶(1)潮湿的CuCl在空气中被氧化,说明有水参加反应,Cu元素的化合价由+1价升高到+2价,O元素的化合价由0价降低到-2价,根据化合价升高总数与降低总数相等,可配出CuCl与O2的化学计量数之比为4∶1,再结合原子守恒,配平后的化学方程式为4CuCl+O2+4H2O 3CuO·CuCl2·3H2O+2HCl。(2)由题意知,OH-参加反应,ClO-被还原成Cl-,同时产物中还有水,C元素的化合价由+2价升高到+4价,N元素的化合价由-3价升高到0价,Cl元素的化合价由+1价降低到-1价,根据化合价升高总数与降低总数相等,CN-的化学计量数为2,ClO-的化学计量数为5,再结合原子守恒,配平后的离子方程式为2CN-+5ClO-+2OH- 2CO32-+N2↑+5Cl-+H2O。(3)反应中FeO42- Fe3+,Fe元素的化合价从+6价降低到+3价,得到3个电子,O元素的化合价从-2价升高到0价,失去2个电子,根据得失电子守恒,Fe3+的化学计量数为4,O2的化学计量数为3,再结合原子守恒,配平后的离子方程式为4FeO42-+20H+ 3O2↑+4Fe3++10H2O。
3.写出下列反应的化学方程式或离子方程式。(1)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出CuS与MnO2在稀硫酸中发生反应的化学方程式: 。 (2)已知NaClO3可将UO2转化为UO22+,写出向晶质铀矿(UO2)中滴加硫酸酸化的氯酸钠溶液后发生反应的离子方程式: 。
MnO2+CuS+2H2SO4 MnSO4+S+CuSO4+2H2O
3UO2+6H++ClO3- 3UO22++3H2O+Cl-
4.钼(M)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。(1)配平如下方程式: MS2+ O2 SO2+ MO3。 (2)M可被发烟硝酸氧化,产物MOF4和MO2F2的物质的量之比为1∶1,配平如下方程式: M+ HF+ HNO3 MO2F2+ MOF4+ NO2↑+ 。
一、氧化还原反应方程式的配平技巧1.逆向配平法。自身发生氧化还原反应(包括分解、歧化)的,一般从右边生成物着手配平。2.缺项配平法。化学方程式所缺物质往往是酸、碱或水,离子方程式所缺的往往是H+、OH-或水。以化学方程式的配平为例,可以根据质量守恒先写出所缺物质,再根据得失电子守恒配平。如果无法确定所缺物质,可先依据得失电子守恒将现有的物质配平,然后再根据质量守恒确定所缺物质的化学式及化学计量数。二、新情境下氧化还原反应(离子)方程式的书写思路1.根据所学知识和题目所给信息(包括图像、工艺流程图等),找出氧化还原反应中的氧化剂、还原剂、氧化产物、还原产物。2.标出反应前后化合价有变化的元素的化合价,求化合价升高、降低数目的最小公倍数,使化合价升降的总数目相等(得失电子总数相等),确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。3.用观察法,根据原子守恒,若有缺项物质,先填写缺项物质,再配平化合价无变化的物质的化学计量数。4.若是离子方程式,可借助电荷守恒配平各物质的化学计量数。
3.(2019年江苏卷,18节选)聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2 ml·L-1 K2Cr2O7溶液滴定至终点(滴定过程中Cr2O72-与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。(1)上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将 (填“偏大”或“偏小”或“无影响”)。
(2)计算该样品中铁的质量分数(写出计算过程)
解析▶ (1)根据题意,Sn2+能将Fe3+还原为Fe2+,发生的反应为Sn2++2Fe3+ Sn4++2Fe2+,根据还原性:还原剂>还原产物可知,还原性Sn2+>Fe2+,若实验中不除去过量的Sn2+,则加入的K2Cr2O7先氧化过量的Sn2+再氧化Fe2+,导致消耗的K2Cr2O7溶液的体积偏大,则样品中铁的质量分数的测定结果将偏大。
5.请回答下列问题:(1)用过氧化氢作氧化剂可将Fe2+氧化为Fe3+,若100 L某溶液中Fe2+含量为1.2 ml·L-1,则需投入的氧化剂过氧化氢的质量为 。 (2)取 a g CuCl产品,先加入足量FeCl3溶液使其完全溶解,再稀释到100 mL。从中取出25.00 mL,用c ml·L-1 Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce3+];平行滴定三次,平均消耗标准液的体积为V mL。请写出产品溶于FeCl3溶液的离子方程式: ;产品中CuCl的质量分数为 (用含字母的式子表示)。 (3)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1 g还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为 (结果保留2位小数)。
CuCl+Fe3+ Cu2++Cl-+Fe2+
6.(2019年福建泉州模拟节选)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.380 g产品放入250 mL的碘量瓶中,加入60.00 mL 0.1000 ml·L-1 KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.2500 ml·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。已知:2KMnO4+5NOSO4H+2H2O K2SO4+2MnSO4+5HNO3+2H2SO4(1)配平: Mn O4- + C2O42- + Mn2++ + H2O。 (2)亚硝酰硫酸的纯度= 。
利用得失电子守恒进行计算的解题流程
一、离子方程式的正误判断方法1.“一查”是否符合客观事实如2Fe+6H+ 2Fe3++3H2↑。错因:H+不能把Fe氧化成Fe3+,只能氧化成Fe2+。2.“二查”“ ”“ ”“↑”“↓”是否使用恰当如NaHCO3溶液因水解呈碱性:HCO3-+H2O H2CO3+OH-。错因:HCO3-水解很微弱,应用“ ”表示而不能用“ ”。
3.“三查”拆分是否正确只有易溶于水的强电解质才能拆写成离子,其他物质均不能拆写。如Ca(HCO3)2+2H+ Ca2++2CO2↑+2H2O。错因:未将Ca(HCO3)2拆分成Ca2+和HCO3-。4.“四查”是否漏写离子反应如稀硫酸与氢氧化钡溶液反应:Ba2++SO42- BaSO4↓。错因:忽略了氢离子和氢氧根离子的中和反应。5.“五查”反应物的“量”——过量、少量、足量等如把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH- CaCO3↓+H2O。错因:未考虑反应物中量的关系,正确的离子方程式为2HCO3-+Ca2++2OH- CaCO3↓+2H2O+CO32-。
6.“六查”是否符合三个守恒——质量守恒、电荷守恒、得失电子守恒如Fe3++Cu Fe2++Cu2+。错因:电荷不守恒。7.“七查”是否忽略隐含反应如将少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O CaSO3↓+2HClO。错因:忽略了HClO可以将+4价的硫氧化。
二、离子共存1.熟记因发生离子反应而不能大量共存的几种情况
2.离子共存问题审题“六大”注意(1)注意题干要求:“能、不能、一定、可能、一定不能”,审清关键字。
(4)注意题干中提示的水的电离程度:常温下,当由水电离出的c(H+)或c(OH-)小于1×10-7 ml·L-1时,水的电离受到抑制,溶液可能为酸性溶液或碱性溶液;当由水电离出的c(H+)或c(OH-)大于1×10-7 ml·L-1时,水的电离受到促进,溶液可能为弱酸盐溶液或弱碱盐溶液。(5)注意正确理解“透明溶液”,如NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就不透明。(6)注意题干中提示的“与Al反应放出H2”:溶液既可能显酸性也可能显碱性,但不能是氧化性酸,如HNO3。
1.下列离子方程式能用来解释相应实验现象的是( )。
1.注意典型的易错反应,如Al(OH)3不溶于氨水,Fe与非氧化性酸反应生成Fe2+而不是Fe3+。2.注意是否漏写或忽略某些反应,如硝酸与还原性物质的反应,易忽略硝酸的强氧化性。3.易溶于水、易电离的强电解质必须拆写成离子形式,但弱酸的酸式酸根不能拆;非电解质、弱电解质、难溶物、气体、氧化物不能拆写成离子形式;浓盐酸、浓硝酸必须拆。4.对于连续发生的反应,量不同产物不同,离子方程式也就不同。如多元强碱Ca(OH)2和NaHCO3的反应,弱酸的酸式铵盐NH4HSO3与NaOH的反应,较强酸(或酸酐)与较弱酸的盐反应,如CO2、HCl与Al的反应。5.多种还原剂与氧化剂反应时要注意反应的先后顺序,氧化性和还原性强的先反应。如FeBr2与Cl2反应,Cl2先与还原性更强的Fe2+反应。6.多个离子反应同时发生时,不能遗漏,如Ba(OH)2与H2SO4反应,容易漏写H+与OH-或Ba2+与SO42-
2.(2019年江苏,4)室温下,下列各组离子在指定溶液中能大量共存的是( )。A.0.1 ml·L-1 NaOH溶液:Na+、K+、CO32-、AlO2-B.0.1 ml·L-1 FeCl2溶液:K+、Mg2+、SO42-、MnO4-C.0.1 ml·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-D.0.1 ml·L-1 H2SO4溶液:K+、NH4+、NO3-、HSO3-
解析▶ 0.1 ml·L-1 NaOH溶液显碱性,四种离子可以大量共存,A项符合题意;0.1 ml·L-1 FeCl2溶液中含有Fe2+,能与MnO4-发生氧化还原反应,不能大量共存,B项不符合题意;0.1 ml·L-1 K2CO3溶液中含有CO32-,能与Ba2+发生反应,不能大量共存,C项不符合题意;0.1 ml·L-1 H2SO4溶液显酸性,此条件下,NO3-和HSO3-能发生氧化还原反应,不能大量共存,D项不符合题意。
2.(2019年湖北恩施质检)室温下,下列各组离子在指定溶液中一定能大量共存的是( )。A.能使甲基橙变黄的溶液中:N、Mg2+、ClO-、NO3-B.0.1 ml·L-1的NH4Al(SO4)2溶液中:K+、Na+、CO32-、Cl-C.透明的溶液中:Cu2+、Fe3+、SO42-、Br-D.由水电离出的c(H+)·c(OH-)=1×10-26 的溶液中:Fe2+、Al3+、NO3-、SO42-
解析▶ 使甲基橙变黄的溶液,可能是酸性溶液、中性溶液或碱性溶液,在碱性条件下N、Mg2+不能大量共存,在酸性条件下ClO-不能大量共存,A项错误;Al3+和CO32-会发生相互促进的水解反应而不能大量共存,B项错误;透明溶液可以是有色溶液,各离子之间不反应,可大量共存,C项正确;水电离出的c(H+)=1×10-13 ml·L-1<1×10-7 ml·L-1,水的电离受到抑制,可能是酸性溶液或碱性溶液,在碱性溶液中,Fe2+、Al3+不能大量共存;在酸性溶液中,Fe2+、NO3-不能大量共存,D项错误。
突破离子共存判断中的常设“陷阱”
1.警惕“颜色”陷阱若限定溶液无色,则Cu2+、Fe3+、Fe2+、MnO4-等有色离子不能大量存在。2.警惕溶液酸碱性的几种表示方法(1)表示酸性的溶液①常温下pH<7或c(H+)>c(OH-)的溶液;②能使紫色石蕊试液或甲基橙显红色的溶液;③能使pH试纸显红色的溶液。(2)表示碱性的溶液①常温下pH>7或c(H+)
3.按要求完成下列各题:(1)用C2O3与浓盐酸反应可制备CCl2·4H2O,写出反应的离子方程式: 。 (2)光气(COCl2)化学性质不稳定,遇水迅速产生两种酸性气体。少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为 。 (3)制备纳米级银粉可用NaOH溶液溶解Na2S2O4,再加入一定量的AgNO3溶液,即生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2∶1,且生成的含硫物质只有一种,写出该反应的离子方程式: 。
COCl2+4OH- CO32-+2Cl-+2H2O
2Ag++S2O42-+4OH- 2Ag↓+2SO32-+2H2O
PbS+2Fe3++4Cl- S+PbCl42-+2Fe2+
离子方程式的书写在工艺流程中的考查,重点考查工艺流程中某一处理步骤发生反应的离子方程式的书写。离子方程式书写的基本要求:
离子推断中的“四注意”
1.注意有颜色的离子与溶液的颜色是否一致。2.根据某现象推出含有的某种离子,注意该离子是否为前面的操作引入的。3.注意离子共存问题(1)离子是否能存在于溶液中,要特别注意溶液的性质(如酸碱性、氧化性、还原性)与离子的性质。(2)推断结果中的离子是否能共存于同一溶液中。(3)离子是否会隐蔽转化,如Al3+遇到过量的强碱转化为AlO2-,AlO2-,遇到过量的强酸转化为Al3+。4.在定量推断中要注意运用溶液的电中性来确定离子的存在。定量推断最后一种离子存在的方法:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带正电荷总数等于阴离子所带负电荷总数。
专题一化学用语与基本概念 选择题专攻1.化学用语的规范使用课件-2024年高考化学二轮复习: 这是一份专题一化学用语与基本概念 选择题专攻1.化学用语的规范使用课件-2024年高考化学二轮复习,共43页。PPT课件主要包含了核心精讲,真题演练,考向预测等内容,欢迎下载使用。
高考化学二轮复习专题13有机化学基础(含解析)课件PPT: 这是一份高考化学二轮复习专题13有机化学基础(含解析)课件PPT,共52页。PPT课件主要包含了对点集训等内容,欢迎下载使用。
高考化学二轮复习专题12物质结构与性质(含解析)课件PPT: 这是一份高考化学二轮复习专题12物质结构与性质(含解析)课件PPT,共40页。












