






所属成套资源:高考化学二轮复习专题培优课件 (含解析)
高考化学二轮专题培优课件——专题五:氧化还原反应 (含解析)
展开
这是一份高考化学二轮专题培优课件——专题五:氧化还原反应 (含解析),共60页。PPT课件主要包含了氧化还原反应,本章要求,配平步骤,注意介质的配平,31原电池,Cu-Zn原电池装置,原电池的电动势,32电极电势,标准状态下,标准电极电势等内容,欢迎下载使用。
§5.1 氧化还原反应的基本概念
§5.5 元素电势图及其应用
§5.3 电极电势
§5.4 电极电势的应用
§5.2 氧化还原反应方程式配平
1. 熟悉氧化还原反应的基本概念,掌握氧化还原反应方程式的配平。2. 了解原电池的组成、作用及表示符号;了解原电池电动势与吉布斯自由能变的关系。3. 熟悉电极电势的概念,能用能斯特公式进行有关的计算。4. 掌握电极电势在有关方面的应用,学会利用电极电势计算反应的平衡常数和溶度积常数等。5. 掌握元素电势图及其用。
§ 5.1 氧化还原反应的
基本概念
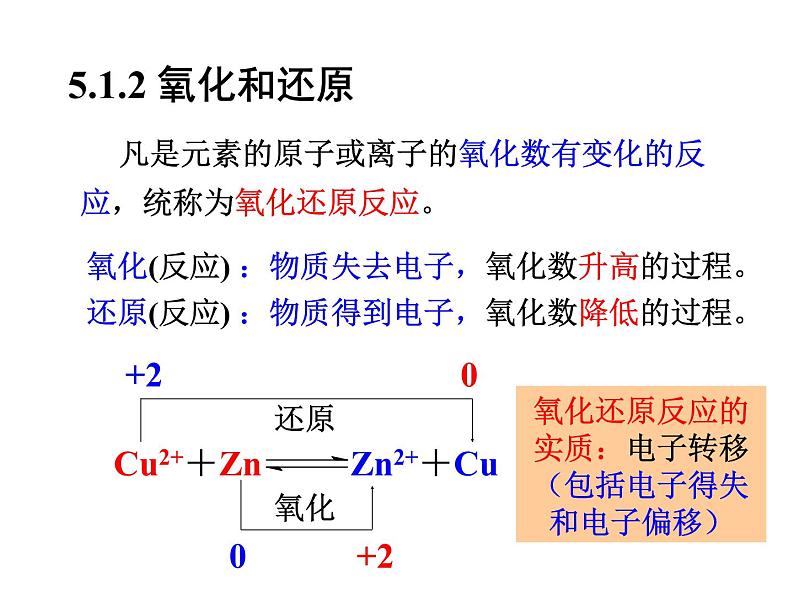
5.1.2 氧化和还原
5.1.1 氧化数
氧化数是某元素一个原子的表观电荷数,这个荷电数可由假设把每个键中的电子指定给电负性更大的原子而求得。(1970年国际纯粹和应用化学联合会IUPAC)
2、 确定氧化值的规则:
①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的电荷数 。 ③在大多数化合物中,氢的氧化值为+1;只有在金属氢化物中氢的氧化值为 -1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF2 和O2F2中,氧的氧化值分别为+2和+1。
⑤中性分子中,各元素原子的氧化值的代数和为零 ,复杂离子的电荷等于各元素氧化值的代数和。
5.1.2 氧化和还原
凡是元素的原子或离子的氧化数有变化的反应,统称为氧化还原反应。
氧化(反应) :物质失去电子,氧化数升高的过程。还原(反应) :物质得到电子,氧化数降低的过程。
氧化还原反应的实质:电子转移(包括电子得失和电子偏移)
氧化剂:氧化数降低的物质。使其它物质氧化,反应中自身被还原。
还原剂:氧化数升高的物质。使其它物质还原,反应中自身被氧化。
还原半反应:Cu2+ + 2e- → Cu 氧化数降低,还原作用,Cu2+:氧化剂 氧化半反应:Zn → Zn2+ + 2e- 氧化数升高,氧化作用, Zn :还原剂
一个完整的氧化还原反应是氧化反应和还原反应这两个半反应组成的。
Zn + Cu2+ ⇌ Zn2+ + Cu可分为:
§ 5.2 氧化还原反应
方程式的配平
5.2.2 离子电子法
5.2.1 氧化数法
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂失电子数。 ② 质量守恒:反应前后各元素原子总数相等。
配平氧化还原方程式使用较多的有氧化数法和离子-电子法。氧化数法较简单,易掌握。离子电子法则可以更清楚地反映氧化还原反应的实质。
【例5-1】采用离子电子法配平下列离子反应方程式(酸性介质): KMnO4 + HCl → MnCl2 + Cl2↑ + H2O
(1) 将反应物和产物以离子形式写出,例如: MnO4- + H+ + Cl- → Mn2+ + Cl2 + H2O
(2) 将氧化还原反应分为两个半反应,一个发生氧 化反应,另一个发生还原反应: Cl- → Cl2 MnO4- + H+ → Mn2+ + H2O
(3) 分别配平两个半反应: 2Cl- → Cl2 + 2e- MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
(4) 确定两个半反应得、失电子数的最小公倍数,将两个半反应分别乘以相应系数,使其得、失电子数相等,再将两个半反应合并为一个配平的氧化还原反应的离子方程式。
最后,在配平的离子方程式中添加不参与反应的阳离子和阴离子,写出相应的化学式,就可以得到配平的氧化还原反应方程式。
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2↑+ 8H2O + 2KCl
§5.3 电极电势
5.3.1 原电池
5.3.2 电极电势
5.3.3 Nernst方程式
5.3.4 原电池的电动势与 △G 的关系
锌与锌离子(铜与铜离子)构成的电极, 又叫半电池。
电池反应(氧化还原反应): Zn + Cu2+ ⇌ Zn2+ + Cu
原电池:使化学能转变为电能的装置。 使电子转移由无序变成有序、定向移动。 负极(氧化反应): Zn - 2e ⇌ Zn2+ 正极(还原反应): Cu2+ + 2e ⇌ Cu
电极反应即半反应:还原态- ne ⇌ 氧化态 氧化态+ne ⇌ 还原态
任意一个氧化还原反应都可以制作成一个电池。对于由非金属单质及其对应的非金属离子(如 H2 和H+,O2 和OH- )、同一种金属不同价的离子(如Fe3+和Fe2+)等构成的电对,在组成电极时常需外加导电体材料,如Pt、石墨(惰性电极)等。
原电池符号的表示: ( - ) Zn | Zn2+(cZn2+ )‖Cu2+(cCu2+) | Cu (+)
(1) 负极在左,正极在右,并用“+”、“-”标明正、负极,把正极与负极用盐桥连接;(2)“ | ”表示两相的界面(电极导体与电解质溶液之间),“‖ ”表示盐桥。不存在相界面的用“,”分开;(3) 应注明溶液的浓度,气体的压力,反应的温度。 如不注明则为标准状态。
规定:所有的离子浓度都为1ml∙L-1,气体压力为100kPa,固体、液体为纯物质,此时的状态称为标准状态。
【例5-2】将氧化还原反应: 2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O设计成原电池,并写出该原电池的符号。
【解】先将氧化还原反应分为两个半反应:氧化反应:2Cl- → Cl2 + 2e-还原反应:MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 原电池的正极发生还原反应,负极发生氧化反应。因此组成原电池时,电对MnO4-/Mn2+为正极,电对Cl2/Cl-为负极。故原电池符号为:(-)Pt|Cl2(p)|Cl-(c1) || H+(c2), Mn2+(c3), MnO4-(c4)|Pt(+)
水从高处(重力势能大)往低处(重力势能小)流动,是由于水位差的存在。
把原电池的两个电极采用导线、盐桥联接起来后,有定向电流产生,说明:两个电极之间有一定的电势(位)差存在;构成原电池的两个电极各自具有不同的电势。
某电极的电极电势用“φ氧化型/还原型”表示,如: φFe3+/Fe2+、φI2/I- 、φ+ 、φ-等。
组成原电池的两个电极的电极电势之差,称为该原电池的电动势,以符号E表示。 则有:E = φ+ - φ-
标准电极电势——用φө 表示。
标准电动势——用Eө 表示。 E ө = φө+ - φө-
2、电极电势产生的原因——双电层理论
德国化学家在1889年提出的“双电层理论”对电极电势给予了解释:因为金属晶体是由金属阳离子和自由电子(公共化)组成的。 当把金属放入含有该金属离子的浓溶液时,有两种反应的倾向存在:一方面是金属表面的离子进人溶液和水分子结合成为水合离子(溶解): M → Mn+(aq) + ne- 金属越活泼,溶液越稀,这种倾向就越大。 另一方面,溶液中的水合离子又有一种从金属表面获得电子,沉积到金属表面的倾向: Mn+(aq) + ne- → M 金属越不活泼,溶液越浓,这种倾向就越大。
这两种对立的倾向在一定条件下,建立暂时的平衡:M ⇌ Mn+(aq) + ne- 金属越活泼,上述平衡向右进行的程度就越大,此时,在极板附近的溶液中有过剩的正电荷,而极板表面上有过剩的负电荷,即在极板表面上形成“双电层”。这样,在金属和盐溶液之间产生了电势差,这种产生在金属和它的盐溶液之间的电势差叫做金属的电极电势。
根据这个理论,可以很好的解释Cu-Zn原电池中检流计偏向的现象:因为Zn比Cu活泼,故Zn电极比Cu电极上的电子密度大(上述平衡更偏向右方),即Zn2+/Zn电对的电极电势比Cu2+/Cu低,所以电子从Zn极流向Cu极。
影响电极电势的因素有:电极的本性、金属离子的浓度、温度、介质等。当外界条件一定时,电极电势的高低就取决与电极的本性。对于金属电极则取决于金属的活泼性大小。
由E = φ+ - φ- 和E ө = φө+ - φө- 可知,只要知道各电极的电极电势,就可以求出原电池的电动势。那么,如何测定电极的电势呢?
电极电势的绝对值迄今为止仍无法测量;采用相对电极电势——类似于海拔高度。
标准氢电极的电极电势为零
1956年起,我国以青岛的黄海海面作为海拔的零点
规定标准状态下氢电极的电极电势为零,即:
H2 (100kPa) ⇌ 2H+(1 ml·L-1) + 2e- ,25℃
φөH+/H2 = 0.0000 (V)
镀有一层疏松铂黑的铂片
因为E ө = φө+ - φө-
【例】测锌电极的电极电势 (-)Zn | Zn2+(cө )‖H+(cө ) | H2( pө ) | Pt (+) 根据检流计偏转方向,测得锌电极为 负极,氢电极为正极,并测得Eө =0.763V。
按国际规定,在标准状态下以标准氢电极作为其中一个电极,待测电极作为另一电极组成原电池,测定其电动势E,就可计算得到该电极的标准电极电势。
0.763 = 0.0000 - φөZn2+/Zn
φөZn2+/Zn = -0.763 V
因为Eө = φө+ - φө-
【例】测铜电极的电极电势 (-) Pt | H2( pө ) | H+(cө ) ‖ Cu2+(cө ) |Cu (+) 根据检流计偏转方向,测得铜电极为正极,氢电极为负极,并测得Eө =0.340 V。
0.340 = φө(Cu2+/Cu) - 0.0000
φө(Cu2+/Cu) = 0.340 V
(1) 根据电极反应溶液的酸碱性来分别查酸表和碱表。 例:Cu2O + H2O + 2e- ⇌ 2Cu + 2OH- 查碱表 Fe3++ e- ⇌ Fe2+ Fe3+、Fe2+易水解,查酸表 总之查表时要注意电对的存在形式、状态和介质等条件。
P489-492附录十四 标准电极电势(298.15K)
氧化型+ ne- ⇌ 还原型
(3) φө值只是反映了物质得失电子的倾向,它与物质的量无关。 例:Cu2++ 2e- ⇌ Cu φө = +0.337V 2Cu2++ 4e- ⇌ 2Cu φө = +0.337V Cu ⇌ Cu2++ 2e- φө = +0.337V
(2) 氧化剂和还原剂的强弱可由φө值来判断: φө值越小,还原型物质是越强的还原剂; φө值越大,氧化型物质是越强的氧化剂。 表是按φө代数值由小到大排列。
5.3.3 能斯特(Nernst)方程
影响电极电势大小的因素
影响电极电势大小的因素:电极本性、测定时的温度、介质的酸碱度、离子浓度和气体压力等。
氧化态 + z e- ⇌ 还原态
法拉第常数(96485C·ml-1)
稀溶液时以c 来代替 a
说明:⑴ 溶液中离子浓度为相对浓度,气体则为 相对分压;⑵ 固体、纯液体的浓度为常数,不写出来;⑶ 电极反应中的H+或OH-也应根据反应式 代入能斯特公式。
(1)Zn2+ + 2 e- ⇌ Zn
(2)2H+ + 2 e- ⇌ H2
(3)MnO4- + 5 e- + 8H+ ⇌ Mn2+ + 4H2O
写出下列电极反应的Nernst方程式
2、浓度对电极电势的影响
【例5-3】计算25℃、c(Zn2+) = 0.001ml·L-1时锌电极的电极电势。
氧化型物质的浓度减小时,电极电势减小,氧化型物质的氧化性减弱; 还原型物质的浓度减小时,电极电势增大,还原型物质的还原性减弱。
【解】Zn2+ + 2 e- ⇌ Zn
= - 0.851(V)
3、 介质酸碱度对电极电势的影响
【例5-4】计算25℃时,MnO4-/Mn2+电极在c(MnO4-) = c(Mn2+) =1ml∙L-1,c(H+) =10ml∙L-1时的电极电势。 (φөMnO4-/Mn2+ = 1.51V)
【解】MnO4- + 5 e- + 8H+ ⇌ Mn2+ + 4H2O
【例5-5】计算Cr2O72-/Cr3+电极在 c(Cr2O72-)=c(Cr3+) =1ml∙L-1, pH=5 时的电极电势。
一般而言,氢离子浓度增大,氧化态的氧化能力增强;反之亦然。
【解】Cr2O72- + 6 e- + 14H+ ⇌ 2Cr3+ + 7H2O
= 0.541 (V)
从热力学中已知,体系的△G 等于系统在等温恒压下对外所做的最大有用功(非膨胀功)。在原电池中如果非膨胀功只有电功一种,那么△G 便与电池电动势之间就有下列关系: -△G = WE = Q·E =z·F·E 即△G = - z·F·E Q:电量。这个式子说明电池的电能来源于化学反应。在反应中,当z ml电子自发地从低电势区流至高电势区,即从负极流向正极,反应的△G转化为电能做了电功。
5.3.4 原电池的电动势与△G的关系
在标准状态下,上式可以写为: △G ө = – z·F·E ө 这样就把热力学和电化学联系起来:测得原电池的电动势Eө,就可以求出该电池的最大电功以及反应的△Gө。反之,亦然。
【解】从上述电池看出锌是负极,铜是正极,电池的氧化还原反应式为 Zn + Cu2+ ⇌ Cu + Zn2+查表:φөZn2+/Zn = - 0.763V,φөCu2+/Cu = 0.337V Eө = 0.337 - (-0.763)=1.100 V △Gө = –zFE ө = - 2×9.648×104×1.10 = - 212.3 kJ·ml-1
【例5-6】根据下列电池写出反应式并计算在25℃时电池的Eө值和△Gө。 (–)Zn|Zn2+(1 ml/L)||Cu2+(1ml/L)|Cu(+)
§ 5.4 电极电势的应用
5.4.1 计算原电池的电动势
5.4.2 判断氧化还原反应进行的方向
5.4.5 判断氧化还原反应进行的程度
5.4.6 测定某些化学常数
5.4.3 选择氧化剂和还原剂
5.4.4 判断氧化还原反应进行的次序
在原电池中,电极电势较大的电极是原电池的正极,电极电势较小的电极是原电池的负极。原电池的电动势等于正极的电极电势减去负极的电极电势: E = φ+ - φ- Eө = φө+ - φө-
5.4.1 计算原电池的电动势
一个氧化还原反应能否自发进行,可用反应的△G来判断,而△G = – z·F·E,电池电动势E = φ+ - φ- 。 当△G < 0 时,E > 0,反应正向进行; 当△G = 0 时,E = 0 ,反应处于平衡状态; 当△G>0 时,E < 0,反应逆向进行。 所以,根据组成氧化还原反应的两电对的电极电势,就可以判断氧化还原反应进行的方向。
5.4.2判断氧化还原反应进行的方向
【例5-7】判断298K时在下列情况下反应Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O的方向。 (1) cCr2O72- = cFe2+ = cH+ = cCr3+ = cFe3+ = 1 ml·L-1 (2) cCr2O72- = 10-5 ml·L-1 , cFe2+ = cH+ = cCr3+ = cFe3+ = 1ml·L-1 (3) cH+ = 10-5 ml·L-1 , cCr2O72- = cFe2+ = cCr3+ = cFe3+ = 1ml·L-1
【解】先分清反应正负极:负极 氧化反应:Fe2+ →Fe3+ + e- 正极 还原反应:Cr2O72- + 6e- + 14H+ = 2Cr3+ + 7H2O(1) φөCr2O72-/Cr3+ =1.33 V > φөFe3+ /Fe2+ = 0.771 V ∴ 反应自左向右进行。
(2) φCr2O72-/Cr3+ = φөCr2O72-/Cr3+ -
= 0.639V < φөFe3+/Fe2+
∴反应自右向左进行。
> φөFe3+/Fe2+
(3) φCr2O72-/Cr3+
在标准条件下,可直接根据两电对的标准电极电势φө的相对大小即可判断反应的方向,而标准电极电势表是按φө值由小到大排列的,所以根据两电对在标准电极电势表中的位置也可知道反应的方向。
结论:电势表左下方的物质能和右上方的物质发生反应,即在表中符合上述对角线关系的物质能互相发生反应。
反应方向: Ag+ + Fe2+ = Ag + Fe3+
有一含有Cl-、Br-、I-的混合溶液,欲使I- 氧化为I2,而Br-和Cl-不发生变化。在常用的氧化剂 H2O2、Fe2(SO4)3 和KMnO4中选择哪一种合适?(设体系在标准状态下)
5.4.3 选择氧化剂和还原剂
要氧化I-而不与Br-、Cl-发生反应,要求电对的电极电势要大于φI2/I-而小于φBr2/Br-和φCl2/Cl-。
φөBr2/Br-、 φөCl2/Cl -> φөFe3+/Fe2+> φөI2/I-
Fe3+ + I - → Fe2+ + I2
刚才已知在Cl-、Br-、I-的混合溶液中,Fe2(SO4)3只能氧化I-,而Br-和Cl-不发生变化。说明I-的还原能力最强,最容易被氧化(φөI2/I-最低),而φөBr2/Br-和φөCl2/Cl-较高,因而Br-、Cl-的还原能力较弱,较难被氧化。
5.4.4 判断氧化还原反应进行的次序
氧化还原反应也是可逆反应,反应进行一段时间后也能到达平衡。根据化学等温方程式及△G与电池电动势的关系: △G ө = - RTlnK ө = - 2.303RTlgK ө = - z·F·E ө lgK ө = z·F·E ө/2.303RT 当T = 298K时,代入各常数,得: lgK ө = z·E ө/0.0592V
【例5-8】求下列反应在298 K时的平衡常K ө:Zn + Cu2+(1.0ml·L-1)=Zn2+(1.0ml·L-1) + Cu
【解】查表得: φөZn2+/Zn = - 0.763V, φөCu2+/Cu = 0.337V Eө = 0.337 - ( -0.763) = 1.100V lgK ө = 2 × 1.100/0.0592=37.2 K ө = 2 × 1037
利用电极电势,可进一步算出难溶电解质的溶度积常数、弱酸弱碱的 解离常数、配合物的稳定常数等。
5.4.5 测定某些化学常数
【例5-9】已知: PbSO4 + 2e- ⇌ Pb+SO42- φө = - 0.359 V Pb2+ + 2e- ⇌ Pb φө = - 0.126 V 求:PbSO4的溶度积Kspө。
【解】把以上两电极反应组成原电池,则电对 Pb2+/Pb为正极, PbSO4/Pb为负极,电池反应为: Pb2+ + SO42- ⇌ PbSO4
Kө=1/[Pb2+][SO42-]= 1/KspөlgK ө=z·E ө/0.0592 lgKspө= -z·E ө/0.0592E ө = φөPb2+/Pb - φөPbSO4/Pb=(-0.126)-(-0.359)=0.233VlgKspө= - (2×0.233) / 0.0592= -7.872 Kspө=1.8×10-8
§ 5.5 元素电势图及其应用
5.5.1 元素电势图
5.5.2 元素电势图的应用
元素电势图:把各电对的标准电极电势以图的形式表示出来。 同一元素如具有多种氧化数,为比较各种氧化数物质的氧化还原性质,常将各物质按该元素氧化数从高到低排列,并将相邻两物质组成的电对的标准电极电势值写在中间联线上,所得图形即为该元素的标准电势图,简称元素电势图。
5.5.1 元素电势图
图中所对应的电极反应是在酸性溶液中发生的:① O2+2H++2e ⇌H2O2 φөO2/H2O2 = 0.682V② O2+4H++4e ⇌2H2O φөO2/H2O = 1.229V③ H2O2+2H++2e ⇌2H2O φөH2O2/ H2O = 1.77V
氧元素的电势图(酸性溶液)
1、 元素电势图直观地反映了同一元素的不同氧化还原电对的氧化(还原)能力。
5.5.2 元素电势图的应用
锰元素的电势图(酸性溶液)
2、元素电势图可以用来判断歧化反应能否发生
歧化反应:氧化数的升高和降低发生在同一物质中的同一种元素上的氧化还原反应。
H2O2: φө右= 1.77V>φө左=0.682V,所以H2O2会发生岐化反应:2H2O2 ⇌ O2 + 2H2O。
3、元素电势图可用于计算任意氧化态之间组成电对时的标准电极电势
利用元素电势图,可以从某些已知电对的标准电极电势计算出另一个电对的未知标准电极电势。例如从下面的电势图求φөMnO4-/MnO2:
将MnO4/MnO42、MnO42/MnO2、MnO4/MnO2分别与标准氢电极组成原电池,相应的电池反应为:①MnO4 + 1/2H2 → MnO42 + H+ Eө1 =0.56V②MnO42 +H2+2H+ →MnO2+2H2O Eө2 =2.26V③MnO4 +3/2H2+H+ →MnO2+2H2O Eө3 =? 反应③ = 反应① + 反应②△rG3ө = △rG1ө + △rG2ө ,而△rGө =– z·F·E ө即 – z3·F·E3ө = – z1·F·E1ө – z2·F·E2ө
φ1ө 、 φ2ө 、 φ3ө … :相邻电对的标准电极电势;z1、z2、z3、… :相邻电对的转移的电子数。
【例5-11】从实验测得φөCu2+/Cu=0.37V, φөCu+/Cu=0.52V,试计算φөCu2+/Cu+ ,并判断Cu+ 能否发生歧化,反应是什么?
z3=z1+ z2=1+1=2
∴ φөCu2+/Cu+=2φөCu2+/Cu- φөCu+/Cu =2 × 0.37-0.52= 0.22 V
【解】Cu元素的电势图:
Cu+能歧化:2Cu+ ⇌ Cu + Cu2+
相关课件
这是一份新高考化学二轮总复习 专题突破课件 专题五 物质结构与性质(含解析),共60页。PPT课件主要包含了218电子微粒,2表示方法,答案D,答案B,答案C,答案A,答案CD,答案AC,K+和P3-,ns1等内容,欢迎下载使用。
这是一份高考化学二轮专题培优课件——专题四:解离平衡 (含解析),共1页。
这是一份高考化学二轮专题培优课件——专题十一:ds区元素 (含解析),共8页。PPT课件主要包含了ds区元素,锌族单质,与O2作用,碱式碳酸铜,银器年久变黑等内容,欢迎下载使用。









