

高考化学三轮冲刺复习课件——晶体专题 (含解析)
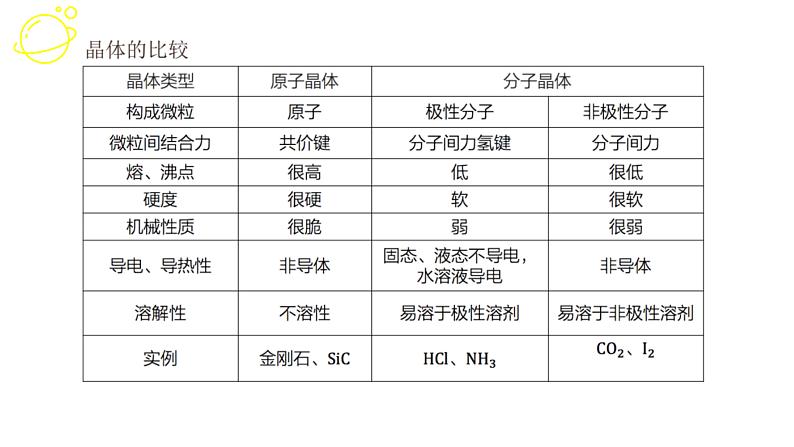
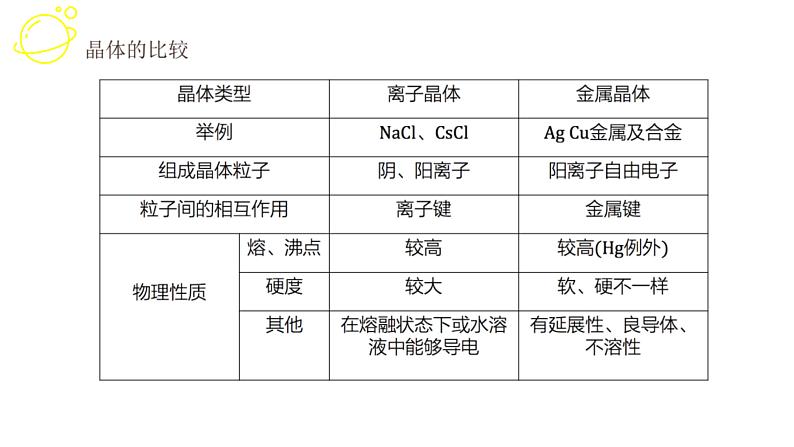
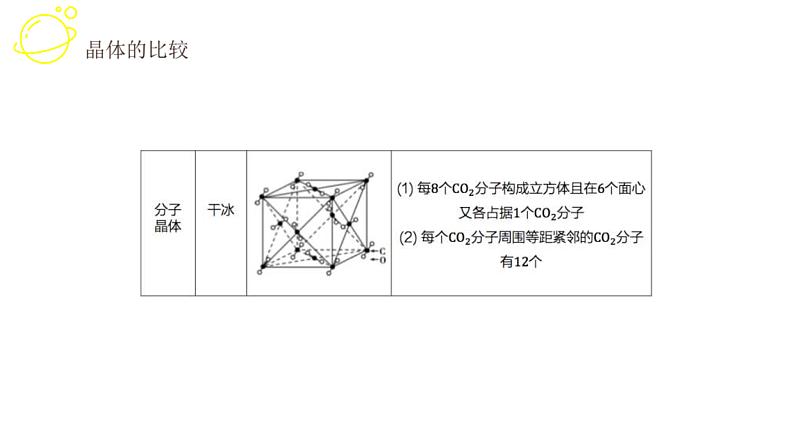
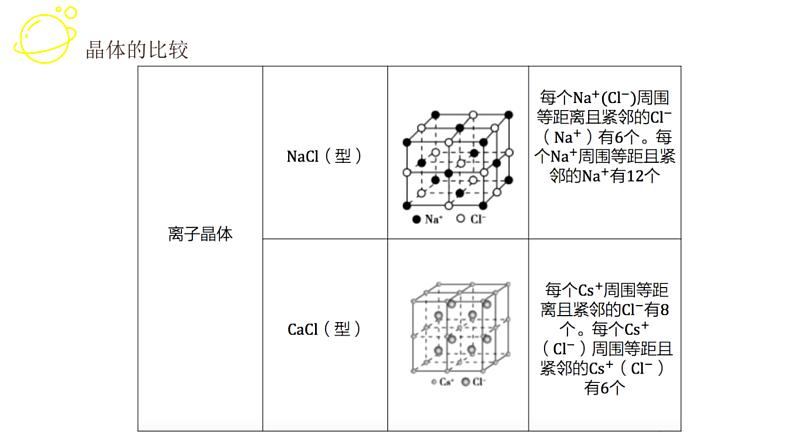
展开1. 晶体类型不同时一般规律:原子晶体>离子晶体>分子晶体,金属晶体有高有低
2. 晶体类型相同时(1)原子晶体中,原子间键长越短,共价键越稳定,物质熔、沸点越高,反之越低。(2)分子晶体中,分子间作用力越大,物质的熔、沸点越高,反之越低(具有氢键的分子晶体的熔、沸点反常,较高)。 对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。
(3)离子晶体中,阴、阳离子半径越小,离子所带电荷数越多,离子键越强,熔、沸点越高,反之越低。(4)金属晶体中,金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子的静电作用越强,熔、沸点越高,反之越低。
钛的化合物如 TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2 等均有着广泛用途。 (1)TiCl4 熔点是-25°C,沸点 136.4°C,可溶于苯或 CCl4,该晶体属于_____晶体;BH4-中 B 原子的杂化类型为____________; (2)在 TiO2 催化作用下,可将 CN-氧化成 CNO-,进而得到 N2。与 CNO-互为等电子体的分子化学式为_________________。(3)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2•H2O(绿色), 两者配位数_______(填“相同”或“不同”),绿色晶体中配体是_______。
共价单键全为?键,双键中有一个?键和一个π键,三键中有一个?键和两个π键某分子的结构式为: A−B=B−A, 则该分子中σ键和 π键的数目之比为________
(1)价层电子互斥(VSEPR)理论:理论要点:共价分子中,中心原子周围电子对排布的几何构型主要取决于中心原子的价层电子对的数目。价层电子对各自占据的位置倾向于彼此分离得尽可能的远,此时电子对之间的斥力最小,整个分子最稳定。 价层电子对包括成键的σ电子对和孤电子对,不包括成键的π电子对 !
(2)价层电子对数的确定方法σ键电子对数:由分子式决定中心原子上的孤电子对数= 1/2 (? − ??)式中?为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子 数;?为与中心原子结合的原子数;?为与中心原子结合的原子最多能接受的电子数, 氢为1,其他原子为“8 −该原子的价电子数”价层电子对数= ?键电子对数+中心原子的孤电子对数 离子计算价电子对数目时,阴离子加上所带电荷数,阳离子减去所带电荷数
(3)杂化类型 sp3杂化 构型109°28′ sp2杂化 构型120° sp杂化构型180°
1个s轨道和3个p轨道杂化形成4个sp3杂化轨道 正四面体型4个sp3杂化轨道可形成4个σ键1个s轨道和2个p轨道杂化形成3个sp2杂化轨道正三角型 3个sp2杂化轨道可形成3个σ键,剩下的一个未参与杂化的p轨道用于形成π键1个s轨道和1个p轨道杂化形成2个sp杂化轨道直线型2个sp杂化轨道可形成2个σ键,剩下的两个未参与杂化的p轨道用于形成π键
① 根据价层电子对数判断
② 在有机物中,碳碳双键、碳氧双键和苯环上的C原子都是sp2杂化,碳碳三键中的C原子是sp杂化单键C原子是sp3杂化③根据等电子体原理判断等电子体不仅结构和性质相似,中心原子的杂化轨道类型也相似。
(4)判断分子的空间构型① 根据价层电子对互斥理论判断。② 利用等电子体原理判断陌生分子的空间构型,如N2O与CO2是等电子体,空间构型均为直线形,N2O的结构式也和CO2相似,为N=N=O。③ 有机物中CH2=CH2、 苯环为平面形结构,CH≡CH 为直线形结构,HCHO为平面三角形结构。
Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 ____________,微粒之间存在的作用力是___________。CS2分子中,共价键的类型有__________,C原子的杂化轨道类型是_____________,写出两个与CS2具有相同空间构型和键合形式的分子或离子___________。气态SeO3分子的立体构型为________,与 SeO3互为等电子体的一种离子为________
PO43−的空间构型是______光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,其分子立体构型为_______,其碳原子杂化轨 道类型为_______杂化。
1. 根据晶体晶胞的结构特点确定晶体的化学式 晶胞中粒子数目的计算(均摊法)顶点:棱:面心:体心:当晶胞为六棱柱时,其顶点上的粒子被6个晶胞共用,每个粒子属于该晶胞的部分为1/6,而不是1/8。
2. 根据晶体晶胞的结构特点和有关数据,求算晶体的密度或晶体晶胞的体积或晶胞参数?(晶胞边长) 对于立方晶胞,可建立如下求算途径得关系式:
(?表示晶胞边长,?表示密度,?A表示阿伏加德罗常数的数值,?表示1???晶胞所含?含基本粒子或特定组合的物质的量,?表示摩尔质量)
下图是某铜矿的晶胞图,请推算出此晶胞的化学式:__________;与?等距离且最近的X原子个数为_________。
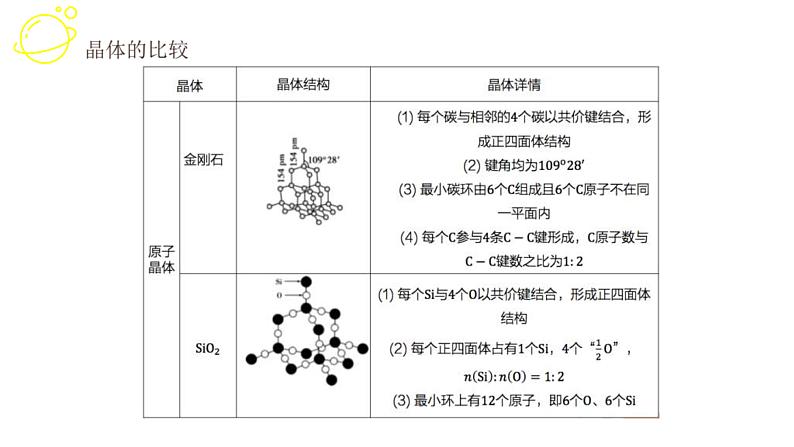
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
(1)在石墨烯晶体中,每个C原子连接______个六元环, 每个六元环占有______个C原子。
(2)在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接______个六元环,六元环中最多有______个C原子在同一平面。
高考化学三轮冲刺复习课件——脂肪烃 (含解析): 这是一份高考化学三轮冲刺复习课件——脂肪烃 (含解析),共33页。PPT课件主要包含了ONE,TWO等内容,欢迎下载使用。
高考化学三轮冲刺复习课件——原子和分子的结构与性质 专题复习 (含解析): 这是一份高考化学三轮冲刺复习课件——原子和分子的结构与性质 专题复习 (含解析),共42页。PPT课件主要包含了CONTENTS,原子结构和元素性质,分子的性质,共价键,ONE,TWO,THREE等内容,欢迎下载使用。
高考化学三轮冲刺复习课件——元素周期律 专题复习 (含解析): 这是一份高考化学三轮冲刺复习课件——元素周期律 专题复习 (含解析),共17页。PPT课件主要包含了同周期元素的递变规律,化学键与氢键,ONE,TWO等内容,欢迎下载使用。












