

所属成套资源:高考化学二轮复习专题练习(含解析)
高考化学二轮复习专题2常见无机物及其应用(含解析)
展开
这是一份高考化学二轮复习专题2常见无机物及其应用(含解析),共23页。试卷主要包含了金属及其化合物,非金属及其化合物等内容,欢迎下载使用。
专题2 常见无机物及其应用
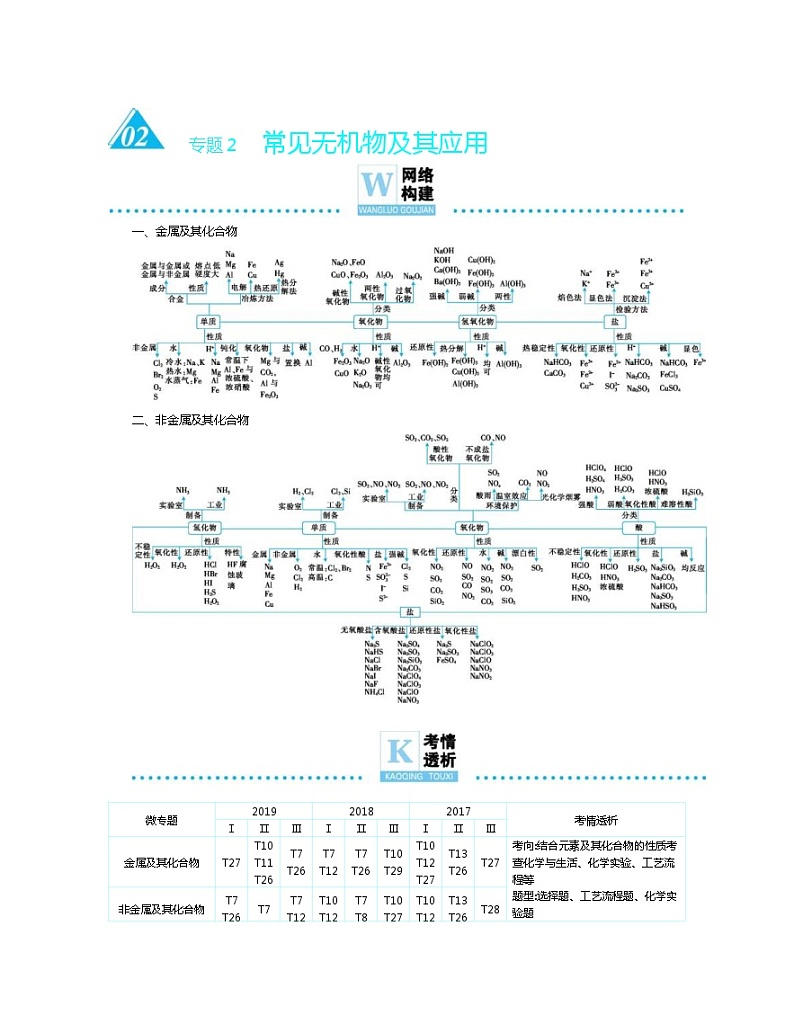
一、金属及其化合物
二、非金属及其化合物
微专题
2019
2018
2017
考情透析
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
金属及其化合物
T27
T10
T11
T26
T7
T26
T7
T12
T7
T26
T10
T29
T10
T12
T27
T13
T26
T27
考向:结合元素及其化合物的性质考查化学与生活、化学实验、工艺流程等
题型:选择题、工艺流程题、化学实验题
分值:6+8
非金属及其化合物
T7
T26
T7
T7
T12
T10
T12
T27
T7
T8
T26
T10
T27
T10
T12
T13
T26
T28
04 金属及其化合物
一、金属活动性顺序表及其应用
金属活动性顺序
K Ca Na
Mg Al Zn
Fe Sn Pb
(H)
Cu Hg Ag
Pt Au
性质变化规律
元素的金属性逐渐减弱,单质的还原性逐渐减弱,离子的氧化性逐渐增强
和水的反应
与冷水剧烈反应生成H2和R(OH)n
与热水缓慢反应生成H2和R(OH)n
与水蒸气反应生成金属氧化物和H2
-
不与水反应
和酸的反应
剧烈反应
与稀盐酸(或稀硫酸)反应放出H2
-
不能置换稀酸中的氢
和强碱溶液的反应
锌、铝可与强碱溶液反应放出H2
和盐溶液的反应
先与水反应
排在前面的金属可将后面的金属从其盐溶液中置换出
和氧气的反应
易被氧化
常温时即被氧化
-
加热时被氧化
不能被氧化
在自然界中的存在形式
只以化合态形式存在
多数以化合态形式存在,极少数以游离态形式存在
只以游离态形式存在
二、金属及其化合物推断题的分析方法
1.特殊的颜色
(1)焰色反应:黄色——Na元素;紫色——K元素;砖红色——Ca元素;黄绿色——Ba元素。
(2)溶液的颜色
溶液的颜色
浅绿色
黄色
蓝色
紫红色
溶液中的离子
Fe2+
Fe3+
Cu2+
Mn
(3)固体的颜色
红色
Cu、Fe2O3(红棕色)
红褐色
Fe(OH)3
绿色
Cu2(OH)2CO3、FeSO4·7H2O
蓝色
Cu(OH)2、CuSO4·5H2O
黑色
CuO、FeO、Fe3O4、MnO2、炭黑
浅黄色
Na2O2、AgBr
白色
Fe(OH)2、CaCO3、BaCO3、BaSO4、AgCl、Al(OH)3、Al2O3、Mg(OH)2、MgO
2.特殊性质
(1)在一定条件下能够漂白有色物质的淡黄色固体只有Na2O2。
(2)遇到SCN-显红色的只有Fe3+。
(3)常见的可在NaOH溶液中溶解的白色沉淀是Al(OH)3。
(4)常见的不溶于水、稀盐酸或稀硝酸的白色沉淀是AgCl、BaSO4。
3.特殊反应
(1)能与强酸溶液反应产生气体的物质:排在H前面的活泼金属、不稳定弱酸对应的盐(如碳酸盐、碳酸氢盐、亚硫酸盐、亚硫酸氢盐等)。
(2)能与强碱溶液反应产生气体的物质:金属单质,如铝;盐类中的铵盐,如硫酸铵、硝酸铵等。
(3)既能与强酸溶液反应又能与强碱溶液反应的物质:金属单质,如铝等;两性氧化物,如Al2O3;两性氢氧化物,如Al(OH)3;弱酸的铵盐,如碳酸铵、碳酸氢铵、亚硫酸铵、亚硫酸氢铵;弱酸的酸式盐,如碳酸氢钠、硫氢化钠等。
(4)能与冷水反应产生气体的物质:活泼金属中的K、Ca、Na,Na2O2。
考点1
▶ 金属及其化合物之间的转化
1.
(2019年陕西渭南中学高三质检)X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示转化一步完成)。下列各组物质中,不能满足此转化关系的是( )。
选项
X
Y
Z
A
Al
Al2O3
NaAlO2
B
Fe
FeCl3
FeCl2
C
C
CO
CO2
D
Cl2
HCl
NaCl
解析▶ A项,铝与氧气反应生成氧化铝,氧化铝与氢氧化钠反应生成偏铝酸钠,但偏铝酸钠无法一步制得单质铝,所以不能满足ZX的转化,B项,铁与氯气反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁溶液与锌反应生成单质铁,可以实现以上转化;C项,碳与二氧化碳反应生成一氧化碳,一氧化碳与氧气反应生成二氧化碳,二氧化碳与镁反应生成单质碳,可以实现以上转化;D项,氯气在氢气中燃烧生成氯化氢,氯化氢与氢氧化钠反应生成氯化钠,电解熔融的氯化钠生成氯气,氯气与钠反应生成氯化钠,可以实现以上转化。
答案▶ A
1.(2019年安徽合肥高三调研)在给定条件下,下列物质间转化均能一步实现的是( )。
A.FeFe2O3FeCl3(aq)
B.N2NH3NO
C.SiO2H2SiO3Na2SiO3(aq)
D.Al2O3Al(OH)3AlCl3(aq)
解析▶ A项,Fe与水蒸气在高温条件下反应生成的是四氧化三铁和氢气;B项,氮气和氢气在高温、高压、催化剂条件下反应生成氨气,氨气在催化剂作用下与氧气反应生成一氧化氮和水,物质间转化均能一步实现;C项,二氧化硅与水不反应,D项,氧化铝与氨水不反应,得不到Al(OH)3。
答案▶ B
2.(2019年黑龙江哈尔滨师大附中高三期中)在给定条件下,下列物质间转化均能一步实现的是( )。
A.NaHCO3(s)Na2CO3(s)NaOH(aq)
B.Al(s)NaAlO2(aq)Al(OH)3(s)
C.FeS2SO3H2SO4
D.NaCl(aq)NaNa2O2
解析▶ A项,NaHCO3受热分解成Na2CO3、CO2和H2O,Na2CO3与饱和石灰水反应生成CaCO3和NaOH,两步反应均能实现;B项,Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2与过量盐酸反应生成NaCl、AlCl3和H2O,第二步反应不能实现,C项,煅烧FeS2生成SO2;D项,电解氯化钠溶液得到氢氧化钠溶液、氢气和氯气。
答案▶ A
一、常见金属及其化合物的转化关系
1.直线型转化关系(ABC)
(1)X为O2,如NaNa2ONa2O2。
(2)X为强酸,如NaAlO2Al(OH)3AlCl3。
(3)X为强碱,如AlCl3Al(OH)3NaAlO2。
2.三角型转化关系
二、常见的不能一步转化的反应
金属单质氧化物碱
1.能溶于水的碱[如NaOH、Ba(OH)2等]可通过一步反应实现氧化物到碱的转化。
2.难溶于水的碱[如Al(OH)3、Cu(OH)2等]不能通过一步反应实现氧化物到碱的转化。以Cu(OH)2为例,只能CuOCu2+Cu(OH)2。
考点2
▶ 金属及其化合物在化学实验中的应用
2.(2019年河南郑州实验中学高三期中)下列实验操作、现象、结论均正确的是( )。
选项
实验操作
实验现象
实验结论
A
将过氧化钠投入滴有酚酞试液的水中
溶液最终为红色
过氧化钠与水反应生成碱性物质
B
向Ba(NO3)2溶液中通入SO2气体
产生白色沉淀
SO2具有还原性
C
向FeCl3溶液中加入Cu,振荡
溶液颜色变化为棕黄色→蓝绿色→蓝色
Cu与FeCl3发生了置换反应
D
某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液一定无N
解析▶ 过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠溶液遇到酚酞变红色,因为过氧化钠具有强氧化性,能将酚酞氧化而漂白褪色,溶液最终为无色,A项错误;SO2气体溶于水使溶液呈酸性,酸性条件下,Ba(NO3)2溶液中的N能将具有还原性的SO2氧化为S,继而生成BaSO4沉淀,B项正确;FeCl3溶液与Cu反应生成CuCl2和FeCl2,反应中没有单质生成,该反应不是置换反应,C项错误;氨气极易溶于水,若溶液中含有少量的N,滴加稀NaOH溶液不会放出NH3,D项错误。
答案▶ B
3.(2019年安徽蚌埠一中高三期中)下表中对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )。
选项
陈述Ⅰ
陈述Ⅱ
判断
A
铜绿的主要成分是碱式碳酸铜
可用稀盐酸除去铜器表面的铜绿
Ⅰ对、Ⅱ对;有关系
B
铜表面易形成致密的氧化膜
铜质容器可以盛放浓硫酸
Ⅰ对、Ⅱ错;无关系
(续表)
选项
陈述Ⅰ
陈述Ⅱ
判断
C
银的导电性比铜的好,但导线一般用铜质的而不用银质的
铜比银的熔点高、密度小
Ⅰ对、Ⅱ对;有关系
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ对、Ⅱ对;无关系
解析▶ 铜绿的主要成分为Cu2(OH)2CO3,其能与稀盐酸反应而被除去,而Cu不与稀盐酸反应,A项正确;铜表面不会形成致密的氧化膜,铜在常温下与浓硫酸几乎不反应,可以用铜质容器盛放浓硫酸,B项错误;导线不用银质的是因为导线的用量太大,银比铜贵很多,C项错误;CuSO4·5H2O转化为CuSO4是化学变化,因CuSO4属于重金属盐,能使蛋白质变性,故能用作游泳池的消毒剂,D项错误。
答案▶ A
4.(2019年黑龙江齐齐哈尔模拟)根据下列实验操作和现象所得出的结论错误的是( )。
选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状碳
浓硫酸具有脱水性和强氧化性
B
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中有气泡出现,随后有红褐色沉淀生成
Fe2+催化H2O2分解产生O2
C
铝片先用砂纸打磨,再加入浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下,铝被浓硝酸钝化
D
向浓度均为0.1 mol·L-1的KCl、KI混合液中逐滴滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
解析▶ 浓硫酸能将有机物中H、O元素以水的形式脱去而体现脱水性,将C元素氧化成二氧化碳而体现强氧化性,A项正确;溶液变为棕黄色,说明H2O2溶液氧化硫酸亚铁溶液生成Fe3+,一段时间后,溶液中有气泡生成,则说明溶液中的Fe3+催化H2O2分解产生O2,起催化作用的不是Fe2+,B项错误;铝片先用砂纸打磨,再加入浓硝酸中,由于浓硝酸具有强氧化性,常温下,铝与浓硝酸发生钝化反应,没有明显现象,C项正确;AgCl、AgI组成相似,则溶度积小的物质先生成沉淀,向浓度均为0.1 mol·L-1的KCl、KI混合溶液中逐滴滴加AgNO3溶液,先出现黄色沉淀,可说明Ksp(AgCl)K>sp(AgI),D项正确。
答案▶ B
常见金属阳离子的除杂或净化方法
主要离子
杂质离子
除杂方法
Fe3+
Fe2+
加入H2O2溶液
Fe2+
Fe3+
加入过量铁粉,过滤
Fe2+
Cu2+
加入过量铁粉,过滤
Mg2+
Fe3+
加入Mg或MgO或MgCO3或Mg(OH)2,过滤
Mg2+
Fe2+
先加入H2O2溶液,再加入Mg或MgO或MgCO3或Mg(OH)2,过滤
Cu2+
Fe3+
加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,过滤
Cu2+
Fe2+
先加入H2O2溶液,再加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,过滤
考点3
▶ 金属及其化合物的性质与用途
3.(2019年山东临沂期末)下列有关物质的性质与用途具有对应关系的是( )。
A.FeCl3具有氧化性,可用作H2S的脱除剂
B.Al2O3具有两性,可用于工业冶炼铝单质
C.浓硝酸具有酸性,可用于钝化铁、铝
D.氧化铁能与酸反应,可用于制作红色涂料
解析▶ Fe3+具有强氧化性,H2S具有还原性,Fe3+能将-2价的S元素氧化,因此FeCl3可用作H2S的脱除剂,A项正确;氧化铝具有两性与工业冶炼铝单质无因果关系,B项错误;浓硝酸可用于钝化铁、铝,利用的是浓硝酸的强氧化性,不是酸性,C项错误;氧化铁为红棕色固体,可用于制作红色涂料,与化学性质无关,D项错误。
答案▶ A
5.(2019年江苏南通海安高级中学检测)下列有关物质的性质与用途均正确且具有对应关系的是( )。
A.碳酸钠溶液具有碱性,可用于治疗胃酸过多
B.氧化镁熔点高,可用于制造耐火材料
C.钠的金属性比钾弱,钾与NaCl溶液反应制取单质Na
D.氯化铁溶液呈酸性,可用于蚀刻铜电路板
解析▶ 胃酸的主要成分为盐酸,碳酸钠溶液碱性太强,不能用来治疗胃酸过多,A项错误;氧化镁熔点高且化学性质稳定,可用于制造耐火材料,B项正确;钠和钾都属于活泼金属,都能和水反应放出氢气,所以不能在溶液中制取Na,C项错误;氯化铁与Cu反应生成氯化亚铁和氯化铜,反应中氯化铁表现氧化性,与溶液的酸性无关,D项错误。
答案▶ B
一、重要金属及其化合物的性质和应用
物质
日常应用
原因分析
钠
核反应堆的传热介质
熔点较低,导热性好
过氧
化钠
呼吸面具或潜水艇中作为氧气来源
2Na2O2+2CO22Na2CO3+O2
2Na2O2+2H2O4NaOH+O2↑
碳酸
氢钠
发酵粉、膨松剂
2NaHCO3Na2CO3+H2O+CO2↑
胃酸中和剂
HC+H+H2O+CO2↑
泡沫灭火器
Al2(SO4)3+6NaHCO32Al(OH)3↓+6CO2↑+3Na2SO4
(续表)
物质
日常应用
原因分析
碳酸钠
清洗油污
水解,溶液呈碱性
制玻璃
Na2CO3+SiO2Na2SiO3+CO2↑
氧化铝
耐火材料
熔点高
铝
铝制品
表面易生成致密的氧化膜
铝热剂(焊接钢轨)
2Al+Fe2O3Al2O3+2Fe(放出大量的热)
氢氧
化铝
胃酸中和剂
碱性较弱,Al(OH)3+3H+Al3++3H2O
明矾、
铁盐
净水剂
在水中生成Al(OH)3[或Fe(OH)3]胶体,其可以和悬浮的杂质形成絮状不溶物而沉降下来
氧化铁
红色油漆和涂料
氧化铁是一种红棕色粉末
硫酸铜
配制农药,杀菌消毒
铜离子(重金属离子)能使蛋白质变性
二、几个易混、易错的问题
1.Na在氧气中燃烧,不论氧气是否足量,产物都为Na2O2。
2.Fe与Cl2反应,不论Cl2是否过量,产物都为FeCl3。
3.既能与酸反应又能与碱反应生成气体的物质不一定是Al,还有可能是(NH4)2CO3或NH4HCO3等。
4.向某溶液中加入KSCN溶液,溶液变红,只能说明原溶液中含有Fe3+,无法证明是否含有Fe2+。
05 非金属及其化合物
1.非金属单质的性质
非金属单质
Cl2、Br2、I2、O2、O3、N2、H2、S、C、Si
物理性质
颜色、
状态
①气态的有Cl2、O2、O3、N2、H2;固态的有S、C、Si、I2;Br2为液体。
②Cl2呈黄绿色,Br2呈深红棕色,I2呈紫黑色,S呈淡黄色
溶解性
Cl2、Br2溶于水;S不溶于水、微溶于酒精、易溶于CS2,其他均不易溶于水
化学性质
与O2
反应
①N2与O2在放电或高温条件下反应;
②H2、S、C、Si与O2在加热或点燃条件下反应,其他一般不与O2反应
与H2
反应
①Cl2与H2在光照下爆炸;
②O2与H2在点燃时爆炸;
③N2与H2在高温、高压、催化剂条件下反应
与H2O
反应
①Cl2、Br2与水反应,既作氧化剂,又作还原剂;
②C与水在高温下反应
与碱
反应
Cl2、Br2、I2与碱反应,既作氧化剂又作还原剂
与氧化
剂反应
S、C与强氧化性酸(如浓硫酸、浓硝酸)反应
与还原
剂反应
Cl2、Br2、O2、O3与H2SO3、Na2SO3、H2S、Na2S、Fe2+、I-等还原剂反应
特性及用途
I2使淀粉变蓝,Si作半导体材料
2.常见非金属氧化物的性质
氧化物
CO2、CO、SO2、SO3、NO2、NO、SiO2
物理性质
色、态、味
①除SiO2外其余均为气体;
②除NO2为红棕色外,其他均为无色;
③SO2、NO2有刺激性气味;
④SO2易液化
类型
CO2、SO2、CO2是酸性氧化物;CO、NO、NO2是不成盐氧化物
(续表)
氧化物
CO2、CO、SO2、SO3、NO2、NO、SiO2
化学性质
与H2O
反应
①SO2、SO3、CO2与水反应生成相应酸;
②NO2与水反应生成酸及NO;
③SiO2、NO、CO不溶于水
与碱
反应
CO2、SO2、SO3、SiO2等酸性氧化物与碱反应生成正盐或酸式盐
氧化性
①SO2能氧化H2S;
②CO2、SiO2在高温下能被C还原
还原性
①SO2具有较强还原性,能被Cl2、Br2、I2、O3、Mn(H+)、Fe3+、HNO3等氧化剂氧化为S;
②NO遇空气被氧化为红棕色NO2
特性
①SO2具有漂白性;
②SiO2能与氢氟酸反应;
③2NO2N2O4
环境污染
SO2、NO、NO2、CO均是大气污染物:SO2酸雨,NO、NO2光化学烟雾,CO有毒气体
3.与颜色有关的常见无机物的性质
实验
颜色或焰色
氢气在氯气中燃烧
苍白色
CO在空气中燃烧
蓝色
甲烷、氢气、硫化氢在空气中燃烧
淡蓝色
含钠元素的物质在火焰上灼烧
黄色
含钾元素的物质在火焰上灼烧
紫色(透过蓝色钴玻璃观察)
考点1
▶ 非金属单质及其化合物的性质与应用
1.(2019年禅城区高三调研测试)下列物质性质与应用的因果关系正确的是( )。
A.二氧化硅的熔点高,可用于制备光导纤维
B.焦炭具有还原性,高温下能将二氧化硅还原为硅
C.二氧化锰具有强氧化性,故能将双氧水氧化为氧气
D.Cl2具有强氧化性,故氯水具有杀菌、漂白作用
解析▶ 光导纤维的主要成分是SiO2,利用的是光的全反射,与SiO2的熔点高无关,A项错误;焦炭具有还原性,高温下能将SiO2还原为硅,B项正确;在双氧水分解制氧气时,MnO2作催化剂,与MnO2的氧化性无关,C项错误;氯气和水反应生成HClO,HClO具有强氧化性,能使有色物质褪色,D项错误。
答案▶ B
1.(2019年山东淄博淄川中学高三开学考试)大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的是( )。
选项
俗名
主要成分(化学式)
用途
A
石英
SiO2
制作集成电路板
B
纯碱
Na2CO3
制造玻璃
C
水玻璃
Na2SiO3
制备硅胶
D
铁红
Fe2O3
制作油漆和涂料
解析▶ 石英的主要成分是SiO2,SiO2是制造光导纤维的原料,SiO2不导电,不能用于制作集成电路板,A项错误;Na2CO3的俗名是纯碱,制造玻璃的原料是纯碱、石灰石、石英,B项正确;Na2SiO3的水溶液称为水玻璃,硅酸钠的用途之一是制备硅胶,C项正确;氧化铁俗称铁红,可制作油漆和涂料,D项正确。
答案▶ A
1.NO2与H2O反应生成HNO3,但NO2不是酸性氧化物。
2.干燥的Cl2不具有漂白性,氯水具有漂白性是因为含有的HClO具有强氧化性。
3.SiO2与H2O不反应,但SiO2是酸性氧化物。
4.二氧化硅与氢氟酸反应是二氧化硅的特性,但二氧化硅不是两性氧化物。
5.几个反应中浓度变化对反应的影响:
①Cu+H2SO4(浓);②MnO2+HCl(浓);③Cu+HNO3(浓)。
6.注意区分SO2的还原性和漂白性。如SO2使溴水褪色体现了SO2的还原性;而SO2的漂白原理是它溶于水与有色物质直接化合,形成不稳定的无色化合物。
考点2
▶ 非金属单质的性质在实验中的应用
2.(2019年陕西高三第三次质量检测)气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )。
选项
X
Y
Z
A
NO2
SO2
BaCl2溶液
B
NH3
O2
Al2(SO4)3溶液
C
NH3
CO2
CaCl2溶液
D
CO2
SO2
CaCl2溶液
解析▶ A项,NO2易溶于水生成硝酸,硝酸有强氧化性,SO2有还原性,能被硝酸氧化成硫酸,硫酸和氯化钡发生复分解反应生成白色硫酸钡沉淀;B项,氨气极易溶于水生成氨水,NH3·H2O能电离出OH-,OH-和Al3+反应生成氢氧化铝沉淀,氢氧化铝能溶于强碱但不溶于弱碱,所以一定有白色沉淀生成;C项,氨气极易溶于水生成氨水,氨水呈碱性,能和CO2反应生成碳酸铵,碳酸铵和氯化钙反应生成碳酸钙沉淀;D项,CO2和SO2通入CaCl2溶液中不发生反应,无沉淀产生。
答案▶ D
2.(2019年山东临沂兴华学校高三月考)下列说法正确的是( )。
A.酸雨是指pHI>I2
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
解析▶ 加碘盐中含有NaIO3,其在酸性条件下可被I-还原成I2,故用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝,A项错误;根据途径Ⅲ可知,足量的Cl2与I-反应生成NaIO3,氯气被还原为Cl-,则足量Cl2能使湿润的淀粉-KI试纸褪色的原因可能是5Cl2+I2+6H2O2HIO3+10HCl,B项正确;由途径Ⅰ可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2NaIO3,故氧化性的强弱顺序为Cl2>I>I2,C项正确;根据转化关系2I~I2~10e-可知,生成1 mol I2,反应中转移的电子数为1N0A,D项正确。
答案▶ A
11.(2019年海南海口灵山中学高三第一次测试)硫、氯的单质和化合物应用广泛。请回答下列问题:
(1)将硫铁矿和焦炭按物质的量之比3∶2混合放在炼硫炉中,通入适量空气,发生燃烧反应FeS2+C+O2Fe3O4+CO+S(未配平)。若生成3 mol S,则转移的电子的物质的量为 。
(2)盐酸是应用广泛的酸之一,它具有:a.酸性;b.氧化性;c.还原性;d.挥发性。
①用盐酸除去铁表面的铁锈,盐酸表现了 (填字母),反应的离子方程式为 。
②实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O。盐酸表现了 (填字母),被还原的元素是 ,还原剂是 。
答案▶ (1)6 mol
(2)①a Fe2O3+6H+ 2Fe3++3H2O
②ac Mn HCl(浓)
12.(2019年广东惠州燕岭学校高三月考)铝(熔点660 ℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045 ℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(1)铝属于活泼金属,但能在空气中稳定存在,其原因是 (用化学用语及相关文字说明)。
(2)将0.1 mol·L-1 AlCl3溶液和10% NaF溶液混合制取Na3AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是
。
(3)下列关于氧化铝的叙述正确的是 (填字母)。
A.氧化铝可以治疗胃酸过多
B.氧化铝因熔点高,故可以作耐火材料
C.氧化铝是铝热剂的成分之一
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水
(4)某工厂排放出有毒物质NOCl,它遇水就会生成N。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为 。水源中的N对人类健康会产生危害。为了降低水源中N的浓度,有研究人员建议在碱性条件下用铝粉将N还原为N2,该反应的离子方程式为 。此方法的缺点是处理后的水中含Al,仍可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。已知:25 ℃时,Ksp[Al(OH)3]=1.3×10-33;Al(OH)3Al+H++H2O K=1.0×10-13。25 ℃时,若欲使上述处理后的水中c(Al)降到1.0×10-6 mol·L-1,则应调节pH= ,此时水中c(Al3+)= 。
解析▶ (3)治疗胃酸过多的是氢氧化铝,而不是氧化铝,A项错误;氧化铝是铝热反应的产物之一,不是铝热剂的成分,C项错误;氧化铝能溶于盐酸但不能溶于氨水,D项错误。
(4)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。根据题干信息,反应物为Al、N、OH-,生成物为N2、H2O,碱性条件下Al参加反应时生成物还有Al,依据原子守恒、电荷守恒可知,反应的离子方程式为10Al+6N+4OH-10Al+3N2↑+2H2O。水中c(Al)降到1.0×10-6 mol·L-1,依据Al(OH)3Al+H++H2O K=1.0×10-13可得,c(H+)= mol·L-1=10-7 mol·L-1,pH=7,则c(OH-)=10-7 mol·L-1,Ksp[Al(OH)3]=1.3×10-33,则c(Al3+)=1.3×10-12 mol·L-1。
答案▶ (1)4Al+3O22Al2O3,在空气中铝的表面能够形成一层致密的氧化膜
(2)NaF溶液中的F-水解生成氢氟酸,氢氟酸能与玻璃中的二氧化硅反应,对玻璃有强烈的腐蚀性而对塑料无腐蚀性。
(3)B
(4 10Al+6N+4OH-3N2↑+10Al+2H2O 7 1.3×10-12 mol·L-1
13.(2019年西藏林芝第一中学高三月考)铁及其化合物之间的相互转化可用下式表示:
Fe2+Fe3+Fe(高铁酸根离子)
回答下列有关问题:
(1)Fe2O3中铁元素化合价为 ,实现④的转化需加入 (填“氧化剂”或“还原剂”)。
(2)配平下面的缺项方程式:
FeCl3+ Cl2+ Na2FeO4+ NaCl+ H2O
(3)已知下列反应可以发生:Co2O3+6H++2Cl-2Co2++Cl2↑+3H2O;
2Fe3++S+H2O2Fe2++S+2H+;
Cl2+2Fe2+2Cl-+2Fe3+。
由上述反应可知氧化性:Co2O3 (填“>”或“Cl2,由Cl2+2Fe2+2Cl-+2Fe3+可知,氧化性Cl2>Fe3+,故氧化性Co2O3>Fe3+;由2Fe3++S+H2O2Fe2++S+2H+可知,氧化性Fe3+> S。则氧化性Co2O3>Cl2>Fe3+>S,故离子反应a、c可以发生;由于氧化性Cl2>S,因此b不能发生。
(4)A是金属,能与NaOH溶液反应,则A是Al,反应的离子方程式为2Al+2OH-+2H2O2Al+3H2↑;结合图中分析可得,乙为NaAlO2,B为O2,C为H2,丙为水,甲为氧化铝,A+Fe3O4甲的化学方程式为8Al+3Fe3O44Al2O3+9Fe。
答案▶ (1)+3 还原剂
(2)2 3 16NaOH 2 12 8
(3)> b
(4)①2Al+2OH-+2H2O2Al+3H2 ↑
②8Al+3Fe3O44Al2O3+9Fe
14.(2019年山东济宁一中高三第一次调研)亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
已知:NaClO2饱和溶液在温度低于38 ℃时,析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是 NaClO2,高于 60 ℃时,NaClO2分解成NaClO3和NaCl。
(1)写出“反应”步骤中的还原产物: 。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为 。
(3)“尾气吸收”是吸收“电解”过程中排出的少量ClO2。写出此吸收反应的离子方程式: 。
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④在38~60 ℃下干燥,得到产品。
Ⅱ.检测自来水中残留ClO2的方法如下:
已知:①ClO2存在于pH为4~6的溶液中,Cl存在于中性溶液中;②2Na2S2O3+I2Na2S4O6+2NaI。
(5)取0.5 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式: 。
(6)向(5)所得溶液中滴加 5.00×10-5 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00 mL,该水样中ClO2的浓度是 mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如图所示:
在步骤(3)过程中,溶液又呈蓝色,其原因是 。
解析▶ (3)根据流程图可知,“尾气吸收”是用氢氧化钠、H2O2吸收“电解”过程中排出的少量ClO2,生成NaClO2和氧气,反应的离子方程式是2ClO2+H2O2+2OH-2Cl+2H2O+O2。
(5)向含有ClO2的水样中加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝,说明生成了碘单质和KClO2,反应的化学方程式是2ClO2+2KI2KClO2+I2。
(6)设0.5 L水样中ClO2的质量为x mg,
2ClO2 ~I2 ~ 2S2
135000 mg 2 mol
x mg 5.00×10-5 mol·L-1×0.02 L
=
x=0.0675。
水样中ClO2的浓度为=0.135 mg·L-1。
(7)向(6)所得溶液中加硫酸调节水样pH至1~3,Cl在酸性环境中又将I-氧化为I2,淀粉遇I2变蓝色。
答案▶ (1)ClO2
(2)Na2CO3溶液、NaOH溶液
(3)2ClO2+H2O2+2OH-2Cl+2H2O+O2
(4)用38~60 ℃的温水洗涤
(5)2ClO2+2KI2KClO2+I2
(6)0.135
(7)Cl在酸性环境中又将I-氧化为I2,淀粉遇I2变蓝色
相关试卷
这是一份专题三 元素及其化合物 选择题专攻 2.常见无机物的性质与用途(含解析)-2024年江苏高考化学大二轮复习讲义,共10页。试卷主要包含了氮及其化合物的转化具有重要应用等内容,欢迎下载使用。
这是一份高考化学二轮专题复习专题2 常见无机物及其应用 (含解析),共23页。试卷主要包含了金属及其化合物,非金属及其化合物等内容,欢迎下载使用。
这是一份新疆2023年高考化学模拟题汇编-02常见无机物及其应用,共20页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。








