




所属成套资源:高考化学二轮复习高频考点提分精准突破专题(2份打包,解析版+原卷版,可预览)
高考化学二轮复习高频考点提分精准突破专题06 陌生化学(离子)反应方程式书写(2份打包,解析版+原卷版,可预览)
展开这是一份高考化学二轮复习高频考点提分精准突破专题06 陌生化学(离子)反应方程式书写(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习高频考点提分精准突破专题06陌生化学离子反应方程式书写解析版doc、高考化学二轮复习高频考点提分精准突破专题06陌生化学离子反应方程式书写原卷版doc等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
高频考点06:陌生化学反应方程式书写提分精准突破
1. 基于核心素养的“陌生”反应方程式书写
陌生化学反应方程式书写核心素养体现在“变化观念与平衡思想 证据推理与模型认知”。核心素养生成——(离子)反应方程式书写试题,一般源于生产实际和科研成果等,以解决课堂互动探究化学实际问题为思路进行设问,充分体现了理论与实践相结合的观点。陌生情境方程式书写注重综合考查学生的各种能力,充分体现了化学教育的目的,增强了高考命题中对学生化学核心素养的正确评价,同时促进传统的“应试教育”向“核心素养”的 转化。预测在2020高考中,以化工生产流程、电化学应用和热化学反应等结合题给新信息书写陌生离子方程式(化学方程式),主要以陌生氧化还原反应方程式书写为主。
2. 陌生反应方程式书写两大高频考点精准突破
☆化工流程型陌生化学方程式的书写
化工流程中的陌生化学(离子)方程式的书写。信息“新”、内容别致、陌生度高的信息型化学方程式的书写。首先通过准确、有效接受、吸收试题中的流程、图表等新信息,并将信息与课本知识有机地结合起来,达到以旧带新、触类旁通的作用,进而产生新思路,发现新规律,创造性地解决问题(包括氧化还原反应型和非氧化还原反应型方程式的书写)。
【例析】铈是一种重要的稀土金属元素,以下是其重要化合物Ce(OH)4的一种制备流工艺程图:
(注:高铈是指溶液中Ce为+4价)
①写出加入氨水时发生反应的离子方程式___________________________________。
②“氧化”过程若用NaClO代替O2,写出该反应的离子方程式_________________________________。
(2)将NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,试写出该反应的离子方程式为_____________________________________________________________。
在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。试写出用ClO2氧化除去Mn2+生成MnO2的离子方程式为______________________________________(ClO2反应后的产物为ClO)。
答案 (1)Ce3++3NH3·H2O===Ce(OH)3↓+3NH ②2Ce(OH)3+ClO-+H2O===2Ce(OH)4+Cl-
(2)NCl3+6ClO+3H2O===6ClO2↑+NH3↑+3Cl-+3OH-;Mn2++2ClO2+2H2O===MnO2↓+2ClO+4H+
☆信息型陌生化学反应方程式的书写
“信息型”化学(离子)反应方程式书写一类试题是历年高考的高频考题。该类题的特点是:信息新颖,新旧相承,知识引路,培养能力,它能较好地考查学生接受、提取、处理新信息的能力以及根据新信息结合已有知识分析问题和解决问题的应变能力(包括氧化还原反应型和非氧化还原反应型方程式的书写)。
信息型化学方程式书写题的基本解题思路是:
【例析】高铁酸钾(K2FeO4)是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。该反应的离子方程式为__________________。
(2)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:___________________________________________________________________。
【典例导引】
☆化工流程陌生(离子)反应方程式的书写
【典例1】[2019·课标全国Ⅰ] 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生气体在“吸收”中反应的化学方程式为______ ___。
(2)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为______ ____。
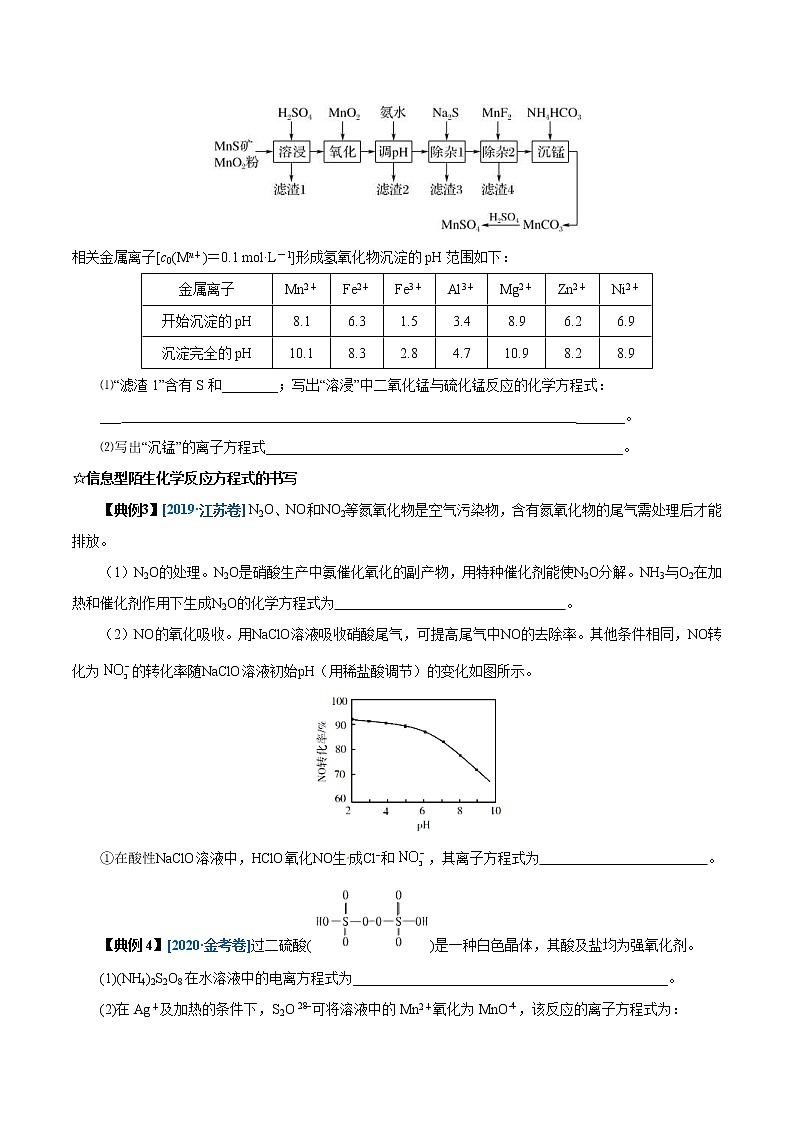
【典例2】 [2019·课标全国Ⅲ,26] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:
___ _______。
⑵写出“沉锰”的离子方程式___________________________________________________。
☆信息型陌生化学反应方程式的书写
【典例3】[2019·江苏卷] N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和,其离子方程式为 。
【典例4】[2020·金考卷]过二硫酸()是一种白色晶体,其酸及盐均为强氧化剂。
(1)(NH4)2S2O8在水溶液中的电离方程式为_____________________________________________。
(2)在Ag+及加热的条件下,S2O可将溶液中的Mn2+氧化为MnO,该反应的离子方程式为:
__________________________________________________,观察到的现象是___________。
(3)由氯磺酸(ClSO3H)与过氧化氢作用可得固态的过二硫酸,该反应的化学方程式为:_____________________________________________________。
【精准巩固】
1.[2020·北京市新高考测试卷改编] Ⅰ.2019 年诺贝尔化学奖授予对锂电池及锂离子电池研究做出贡献的三位科学家。
(1)碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为 ,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式: 。
(2)从正极材料中回收钴和锂的流程如下:
写出酸浸过程中发生反应的化学方程式 。
Ⅱ.K3[Fe(C2O4)3]·3H2O晶体是制备某负载型活性铁催化剂的主要原料,具有工业生产价 值。某化学小组用如下方法制备K3[Fe(C2O4)3]·3H2O晶体。已知:H2C2O4为二元弱酸,具有较强的还原性
ⅰ.称取5g莫尔盐[(NH4)2Fe(SO4)2·6H2O],用15mL水和几滴3mol/LH2SO4溶液 充分溶解,再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀
ⅱ.将沉淀洗涤至中性,加入10mL 饱和K2C2O4 溶液,水浴加热至40℃,边搅拌边 缓慢滴加H2O2溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸30 s,加入8mL饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤, 滤液冷却后,析出翠绿色晶体,过滤、干燥。
(1)步骤ⅰ中黄色沉淀的化学式为FeC2O4·2H2O,生成该沉淀的离子方程式是:
。
(2)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为[Fe(C2O4)3]3-。将下述反应的 离子方程式补充完整:6FeC2O4·2H2O+ + ===4[Fe(C2O4)3]3-+2Fe(OH)3↓+ H2O
2.[2019·新课标Ⅱ]立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
⑴在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
⑵沉淀器中反应的离子方程式为______________________。
3. [2020·淄博市高三下学期入学衔接考](1)采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
(2)下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式:
_______________________ ___________。
4. [2020·首师大附中高三4月开学考] As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
⑴“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应
的化学方程式是________。
⑵ “还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
5. [2018·天津] 为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
6. [2020·淄博高青一中高三下学开学检测](1)实验室用酸性蚀刻废液(含Cu2+、H+、CuCl42-、Cl-等)和碱性蚀刻废液[NH4+、Cu(NH3)42+、NH3. H2O等]制备CuI(白色固体)的实验流程如下:
步骤I中发生了多个反应,其中Cu(NH3)42+与盐酸反应生成Cu(OH)Cl的离子方程式为:
. 。
(2)金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3 ]为原料制备钛的工艺流程如图所示。
滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为:
. 。
7. [2019·北京,26]化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L−1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
则Ⅱ中发生反应的离子方程式是_______________________________。
8.[2020·焦作市五校4月联考]五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
①中V2O5发生反应的离子方程式为______________________。
9.[2018·北京卷] 磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO410CaSO4·0.5H2O+6H3PO4
(1)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:_____ _____。
(2)脱硫时,CaCO3稍过量,充分反应后仍有残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
【精准提分】
1.[2019·江苏卷] 聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为 ;水解聚合反应会导致溶液的pH 。
2. [2020·福州高三4月模拟]如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
(3)写出生成CuCl的化学方程式:____________。
3. [2020·泉州市高三4月检测]利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为__________________________。
(2)滤渣Ⅰ的主要成分是FeS2、S和________(填化学式);Fe3+被FeS2还原的离子方程式为
____________________________________________________________________。
(3)“氧化”中,生成FeOOH的离子方程式为_____________________________________。
4. [2018·课标全国Ⅰ,27]焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_______________________ ____。
(2)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为:______________________ ______。
5. [2020·天津市大港油田实验中学高三4月测试]铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___________
(2)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为___________
6.[2020·黄冈高三调研,28] 某科研课题小组研究利用含H+、Na+、Zn2+、Mn2+、Fe2+、Fe3+、SO的工业废电解质溶液,制备高纯的ZnO、MnO2、Fe2O3,设计实验流程如下:
沉锰反应在酸性条件下完成,写出该反应的离子方程式________________________________。
7. [2017·全国卷Ⅰ] Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式:_____________________________________________________________。
8. [2020·山西名校联盟下学期开学摸底大联考改编]Ⅰ.将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式______________________ ____________;
Ⅱ.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
相关试卷
这是一份高考化学二轮复习提分精准突破专题06 陌生化学(离子)反应方程式书写(含解析),共15页。
这是一份高考化学二轮复习高频考点提分精准突破专题10 滴定(曲线)分析(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习高频考点提分精准突破专题10滴定曲线分析解析版doc、高考化学二轮复习高频考点提分精准突破专题10滴定曲线分析原卷版doc等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份高考化学二轮复习高频考点提分精准突破专题09 实验文字简答(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习高频考点提分精准突破专题09实验文字简答解析版doc、高考化学二轮复习高频考点提分精准突破专题09实验文字简答原卷版doc等2份试卷配套教学资源,其中试卷共51页, 欢迎下载使用。












