





高考化学一轮总复习优化设计 第五单元 第1节 原子结构 元素周期表课件PPT
展开
这是一份高考化学一轮总复习优化设计 第五单元 第1节 原子结构 元素周期表课件PPT,共60页。PPT课件主要包含了必备知识自主预诊,核电荷数,质子数,中子数,核燃料,测定一些文物的年代,自我诊断,关键能力考向突破,答案BD,pdf等内容,欢迎下载使用。
1.了解元素、核素和同位素的含义。2.了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表示式(又叫电子排布图)。4.了解电子在原子轨道之间的跃迁及其简单应用。5.掌握元素周期律的实质;了解元素周期表(长式)的结构(周期、族)及其应用。6.了解金属、非金属元素在元素周期表中的位置及其性质递变规律。
1.宏观辨识与微观探析:从能层、能级等不同层次认识原子的结构以及核外电子的排布规律,能从宏观和微观相结合的视角分析原子结构与元素性质的关系。2.证据推理与模型认知:运用构造原理和能量最低原理,揭示元素原子核外电子排布的规律。3.变化观念与平衡思想:多角度、动态地分析核外电子的运动状态及原子结构的变化规律,认识元素性质的变化规律。
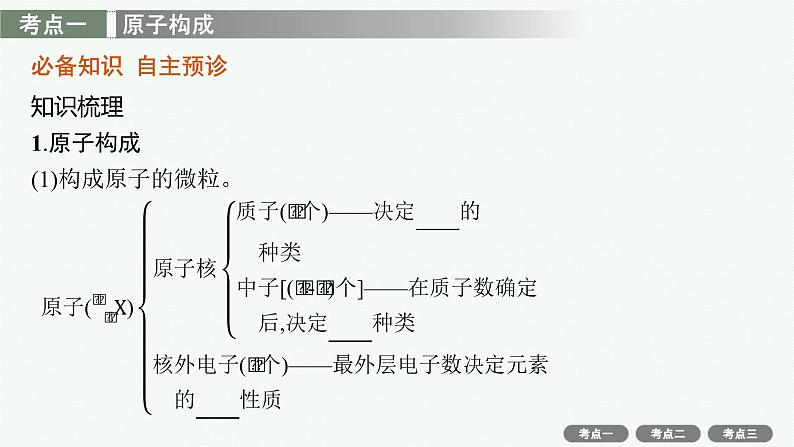
知识梳理1.原子构成(1)构成原子的微粒。
①质子数(Z)=核电荷数=原子的核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-阳离子所带的电荷数;④阴离子的核外电子数=质子数+阴离子所带的电荷数。
(2)微粒的基本关系式。
(3)有关元素的相对原子质量与核素质量数的注意事项。①原子的相对原子质量≠原子的质量数。②只有具体的原子才有质量数,元素没有质量数。③某核素的质量数可视为该核素的近似相对原子质量。
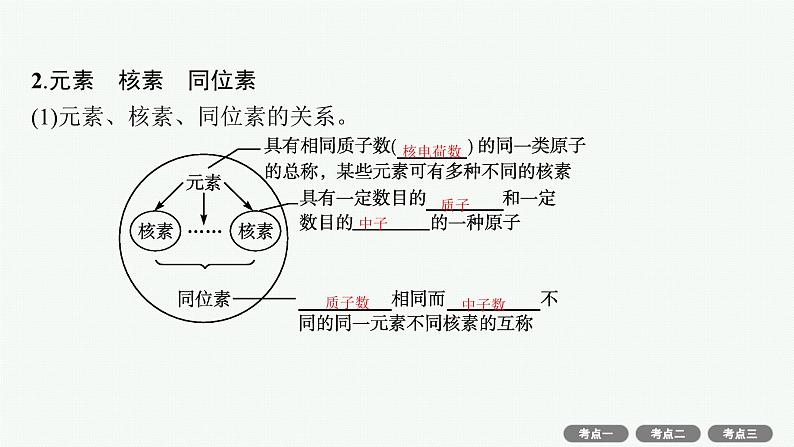
2.元素 核素 同位素(1)元素、核素、同位素的关系。
(2)同位素的性质。同一元素不同核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。(3)氢元素的三种核素。
(4)几种重要核素的用途。
(5)一种元素可以有多种核素,也可能只有一种核素。(6)同位素之间的转化,既不是物理变化也不是化学变化,是核反应。(7)同位素是指同一元素的不同核素之间的关系,同素异形体是指同一元素的不同单质间的关系。
1.判断正误,正确的打“√”,错误的打“×”。(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。( )
(4)一种核素只有一种质量数。( )
(5)硫离子的结构示意图为 ( )(6)最外层电子数为8的粒子一定是稀有气体元素的原子。( )(7)核外电子排布相同的微粒化学性质也相同。( )
答案 (1)√ (2)× (3)√ (4)√ (5)× (6)× (7)×
考向1 核素、同位素等易混概念辨析【典例1】 (2020浙江7月选考,7)下列说法正确的是( )A.35Cl和37Cl是两种不同的元素B.单晶硅和石英互为同素异形体C.HCOOH和HOCH2CHO互为同系物D.H与Na在元素周期表中处于同一主族
答案 D 解析 35Cl和37Cl同是氯元素,二者互为同位素的关系,A项错误;单晶硅是硅单质,石英的主要成分是SiO2,B项错误;HCOOH和HOCH2CHO不是同类物质,不是同系物的关系,C项错误。
对点演练1(2020辽宁锦州期末)地表水和地下水都来源于大气降水,但重水和轻水中同位素的含量不同。氢包括两种稳定核素:H和D,氧常见的核素包括:16O、17O和18O,下列有关说法正确的是( )A.H2和D2互为同分异构体,其化学性质完全相同
答案 D 解析 同分异构体一般指分子式相同,结构不同的有机化合物,H2和D2都是无机物,A错误;16O、17O、18O互为同位素, 既不互为同位素,也不互为同素异形体,B错误;18O2和18O3互为同素异形体,但温度、压强未知,它们的密度之比不一定为2∶3,C错误;电解一定量的 O时,阴、阳两极会收集到物质的量之比为2∶1的D2和18O2,其质量之比约为2∶9,D正确。
易混辨析 元素、核素、同位素、同素异形体的辨析
考向2 各种微粒数目之间的关系及计算
其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )A X的相对原子质量为26B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸
答案 B 解析 依据题给的反应过程,可确定W=27。根据X、Y的最外层电子数之和为8,Y原子的质子数比X原子的质子数多2,可以得出X原子最外层电子数为3,Y原子最外层电子数为5,结合Y的质量数为30可以判定X为铝元素,Y为磷元素。由上述分析可知A项错误;Al、P两元素均可形成三氯化物AlCl3和PCl3,B项正确;Al、P两元素位于同一周期且原子序数P大于Al,故原子半径Al大于P,C项错误;磷元素的含氧酸有H3PO4、H3PO3、H3PO2等,D项错误。
对点演练3下列说法不正确的是( )①质子数相同的粒子一定是同种元素②同位素的性质几乎完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数⑥某种元素的相对原子质量取整数,就是质量数A.②③④⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥
答案 C 解析 粒子包括原子、分子、离子等。H2O与Ne的电子数、质子数均相同,故①错误、④正确;一种分子和一种离子,如果质子数相等,其电子数一定不相等,如O2与S2-,故③正确;同位素的化学性质几乎完全相同,而物理性质有所不同,故②错误;质量数是针对某原子而言的,某些元素往往有几种同位素,它们的质量数各不相同,故⑤⑥错误。
深度指津 (1)微粒符号周围数字的含义。
(2)求一定质量的某物质中粒子数的答题模板
(3)①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴离子、阳离子中质子数与电子数不相等。②有质子的微粒不一定有中子,如1H;有质子的微粒不一定有电子,如H+。③质子数相同的微粒不一定属于同一种元素,如F-与OH-。④核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+,F-、N 和OH-等。
(4)两种相对原子质量。①原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的 的比值。一种元素有几种核素,就有几种不同核素的相对原子质量。②元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
知识梳理1.能层与能级(1)能层(n):在多电子原子中,核外电子的 是不同的,按照电子的 差异将其分成不同能层。通常用K、L、M、N等表示,能量依次升高。 (2)能级:同一能层里电子的 也可能不同,又将其分成不同的能级,通常用 ……表示。同一能层里,各能级的能量按 ……的顺序依次升高,即: ……。
E(ns)HS-(或OH->S2-)。
归纳总结等电子微粒(1)10电子微粒。
(2)18电子微粒。
【典例3】 按要求填空:(1)(2020江苏化学,21节选)基态Fe原子的核外电子排布式为 。 (2)(2020全国2,35节选)基态Ti原子的核外电子排布式为 。 (3)(2019全国2,35节选)Fe成为阳离子时首先失去 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为 。
考向3 电子排布式、轨道表示式(或电子排布图)的书写
(4)(2019江苏化学,21节选)Cu2+基态核外电子排布式为 。 (5)(2018全国1,35节选)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:①下列Li原子电子排布图表示的状态中,能量最低和最高的分别为 、 (填标号)。
②Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是 。 (6)(2018全国2,35节选)基态Fe原子价层电子的电子排布图(轨道表示式)为 ,基态S原子电子占据最高能级的电子云轮廓图为 形。
答案 (1)[Ar]3d64s2或1s22s22p63s23p63d64s2(2)1s22s22p63s23p63d24s2或[Ar]3d24s2(3)4s 4f5 (4)[Ar]3d9或1s22s22p63s23p63d9(5)①D C ②Li+核电荷数较大
解析 (1)Fe为26号元素,价电子数为26-18=8,在4s轨道上填充2个电子,在3d轨道上填充6个电子,则基态Fe原子的核外电子排布式为[Ar]3d64s2或1s22s22p63s23p63d64s2。(2)钛元素是22号元素,故其基态原子的核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2。(3)Fe为26号元素, Fe原子核外电子排布式为1s22s22p63s23p63d64s2, Fe原子失去1个电子使4s轨道为半充满状态,能量较低,故首先失去4s轨道电子;Sm的价电子排布式为4f66s2,失去3个电子变成Sm3+成为稳定状态,要失去最外层6s上的2个电子和4f上的1个电子,所以Sm3+的价电子排布式为4f5。(4)Cu位于第四周期第ⅠB族,其价电子排布式为3d104s1,因此Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。
(5)①根据电子排布图(轨道表示式)可知,对应的四种电子排布式分别是1s12s2、2s22p1、2s12p2、1s22s1,根据构造原理可知能级能量大小关系是:1s








