





高考化学一轮总复习优化设计 第八单元 第2节 水的电离和溶液的pH课件PPT
展开
这是一份高考化学一轮总复习优化设计 第八单元 第2节 水的电离和溶液的pH课件PPT,共60页。PPT课件主要包含了必备知识自主预诊,水的离子积常数,关键能力考向突破,答案A,答案BC,相对大小,-lgcH+,答案C,答案D,酸或碱等内容,欢迎下载使用。
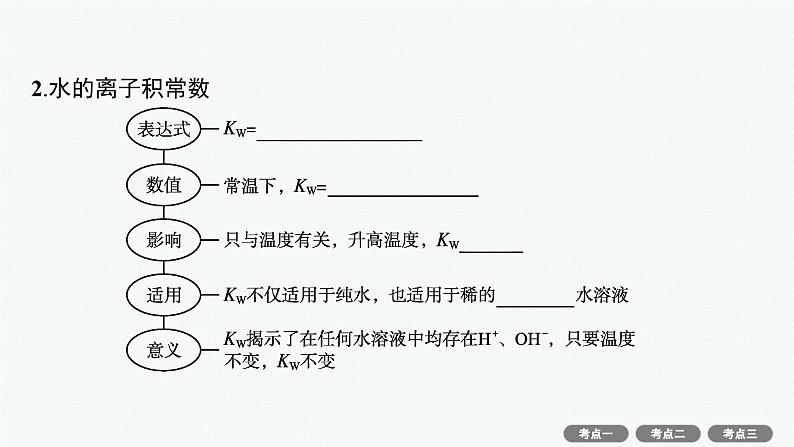
知识梳理1.水的电离水是极弱的电解质,水的电离方程式为 或简写为H2O H++OH-,其电离过程 (填“吸热”或“放热”)。任何水溶液中水电离出的H+和OH-都是相等的,25 ℃纯水中c(H+)=c(OH-)= 。
H2O+H2O H3O++OH-
1×10-7 ml·L-1
微点拨 水的离子积常数KW=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说KW是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即KW不仅适用于纯水,还适用于酸性或碱性的以水为溶剂的稀溶液。
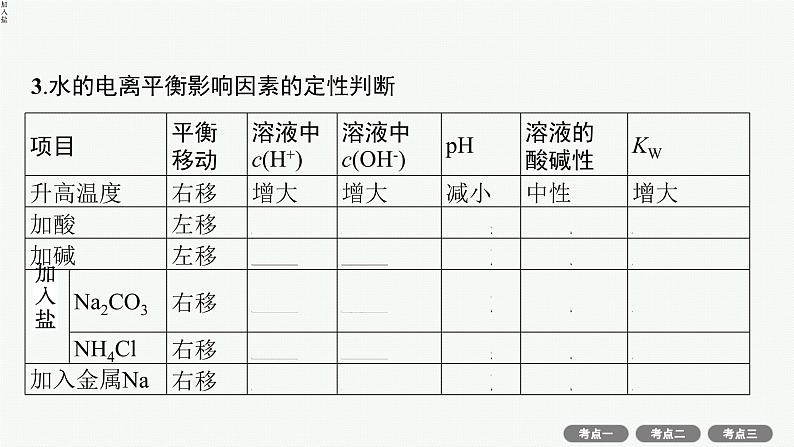
3.水的电离平衡影响因素的定性判断
微点拨 水中加酸或碱对水的电离均有抑制作用,因此,在常温下,若由水电离出的c(H+)T2>T1B.图中pH关系:pH(B)=pH(D)=pH(E)C.图中五点KW间的关系:E>D>A=B=CD.C点可能是显酸性的盐溶液
答案 D 解析 水的电离是吸热过程,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大,根据题图知,离子积常数:T3>T2>T1,所以温度:T3>T2>T1,A项正确;B、D、E三点溶液的氢离子浓度相等,则pH相等,B项正确;温度高低顺序是A=B=CA=B=C,C项正确;C点时,KW=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D项错误。
对点演练1(2020北京平谷一模)某同学探究温度对溶液pH的影响,加热一组试液并测量pH后得到如表数据(溶液浓度均为0.1 ml·L-1)。下列说法正确的是( )
A.随温度升高,纯水的KW逐渐减小B.随温度升高,NaOH溶液pH变化主要受水电离平衡变化影响C.随温度升高,CH3COOH的电离促进了水的电离D.随温度升高,CH3COONa溶液的pH减小,说明水解程度减小,c(CH3COO-)增大
答案 B 解析 升高温度,促进水的电离,由溶液pH变化可知,随温度升高,纯水的KW逐渐增大,A错误;加热NaOH溶液,pH减小,原因是升温促进水的电离,氢离子浓度增大,B正确;加热促进醋酸的电离,但醋酸电离抑制水的电离,C错误;醋酸钠的水解为吸热过程,加热促进其水解,D错误。
考向2 水电离出的c水(H+)或c水(OH-)及其计算【典例2】 25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 ml·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)C.1∶20∶1010∶109D.1∶10∶104∶109
对点演练2(双选)(2020山东德州一模)常温下,向V mL 0.1 ml·L-1 HA溶液中滴入0.1 ml·L-1 NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )A.常温下,Ka(HA)约为10-5B.P点溶液对应的pH=7C.M点溶液中存在:c(Na+)=c(A-)+c(HA)D.N点溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
解析 由示意图可知,0.1 ml·L-1 HA溶液中水电离出的氢离子浓度为10-11 ml·L-1,溶液中氢离子浓度为10-3 ml·L-1,HA为弱酸,N点水电离出的氢离子浓度的负对数最小,水电离出的氢离子浓度最大,说明HA溶液与NaOH溶液恰好完全反应生成NaA,则M点为HA和NaA的混合液,P点为NaA和NaOH混合液。0.1 ml·L-1 HA溶液中氢离子浓度为10-3 ml·L-1,则
P点为NaA和NaOH混合液,溶液呈碱性,溶液的pH>7,B错误;M点为HA和NaA的混合液,溶液呈中性,溶液中c(OH-)=c(H+),由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知,溶液中c(Na+)=c(A-),C错误;N点HA溶液与NaOH溶液恰好完全反应生成NaA,A-在溶液中水解使溶液呈碱性,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+),D正确。
深度指津 水电离出的c(H+)水或c(OH-)水的相关计算(25 ℃)(1)中性溶液:c(H+)=c(OH-)=1.0×10-7ml·L-1。(2)溶质为酸的溶液。①来源。OH-全部来自水的电离,水电离产生的c(H+)水=c(OH-)。②实例。如计算pH=2的盐酸中由水电离出的c(H+)水,方法是先求出溶液中的c(OH-)= ml·L-1=10-12ml·L-1,即由水电离出的c(H+)水=c(OH-)=10-12ml·L-1。
(3)溶质为碱的溶液。①来源。H+全部来自水的电离,水电离产生的c(OH-)水=c(H+)。②实例。如计算pH=12的NaOH溶液中由水电离出的c(OH-)水,方法是根据溶液中的c(H+)=10-12ml·L-1,推出由水电离出的c(OH-)水=c(H+)=10-12 ml·L-1。
(4)水解呈酸性或碱性的盐溶液。①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离出的c(H+)水=10-5ml·L-1,因为部分OH-与部分N 结合,溶液中c(OH-)=10-9ml·L-1。②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)水=10-2ml·L-1。
知识梳理1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的 。 将“>”“=”或“7的溶液不一定呈碱性B.中和pH和体积均相等的氨水、NaOH溶液,所需HCl的物质的量相同C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(OH-)相等D.氨水和盐酸反应后的溶液,若溶液呈中性,则c(Cl-)=c(N )
答案 B 解析 A项,pH与温度有关,正确;B项,pH相等的氨水和NaOH溶液,氨水的浓度比NaOH浓度大,所以等体积的两者,氨水消耗的HCl多,错误;C项,相同温度下,pH相等的盐酸和CH3COOH溶液,c(H+)相等,根据水的离子积KW=c(H+)·c(OH-)知,c(OH-)相等,正确;D项,根据溶液中电荷守恒知,c(H+)+c(N )=c(OH-)+c(Cl-),溶液呈中性,c(H+)=c(OH-),则c(N )=c(Cl-),正确。
对点演练1已知温度T时水的离子积常数为KW,该温度下,将浓度为a ml·L-1的一元酸HA溶液与b ml·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是( )A.a=bB.混合溶液的pH=7C.混合溶液中,c(H+)= ml·L-1D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
答案 C 解析 选项A,a=b只能说明酸、碱恰好完全反应,生成盐和水,由于酸、碱强弱未知,不能说明溶液呈中性,错误;选项B,题给温度未指明是25 ℃或常温,所以pH=7并不能说明溶液呈中性,错误;选项C,由于混合溶液中c(H+)= ml·L-1,结合KW=c(H+)·c(OH-),可推断出c(H+)=c(OH-),所以溶液一定呈中性,正确;选项D是正确的电荷守恒表达式,无论溶液是否呈中性都满足此式,错误。
归纳总结 溶液酸碱性的两种判断方法
(2)常温下,已知pH之和的酸、碱溶液等体积混合所得溶液的酸碱性分析。①两强混合。a.若pH之和等于14,则混合后溶液显中性,pH=7。b.若pH之和大于14,则混合后溶液显碱性,pH>7。c.若pH之和小于14,则混合后溶液显酸性,pHc(A-)>c(H+)>c(HA)
考向2 酸碱中和滴定曲线分析【典例2】 (双选)(2020山东等级考模拟一)25 ℃时,向10 mL 0.10 ml·L-1的一元弱酸HA(Ka=1.0×10-3)溶液中逐滴加入0.10 ml·L-1 NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
解析 a点处的溶质为HA和NaA,a点电荷守恒为:c(A-)+c(OH-)=c(Na+)+c(H+),溶液中HA的电离平衡常数为Ka= =1.0×10-3,a点处,pH=3,c(H+)=1.0×10-3 ml·L-1,代入Ka,得c(A-)=c(HA),所以电荷守恒式可以改写成:c(HA)+c(OH-)=c(Na+)+c(H+),A项正确;a点溶质为HA和NaA,pH=3,以HA酸对水的电离抑制为主,b点溶质为NaOH和NaA,pH=11,以NaOH对水的电离抑制为主,二者pH之和为14,所以两点水的电离程度相等,B项正确;b处的电荷守恒方程式为:
c(A-)+c(OH-)=c(Na+)+c(H+),则c(Na+)c(A-)>c(HA)>c(H+),D项错误。
对点演练3(双选) (2020山东烟台一模)298 K时,向20 mL 0.100 0 ml·L-1 CH3COOH溶液中滴入0.100 0 ml·L-1 NaOH溶液,滴定曲线如图所示(忽略温度变化)。下列说法正确的是( )
A.该滴定过程应该选择石蕊溶液做指示剂B.由c点数值可求醋酸的电离平衡常数为1.66×10-5 ml·L-1C.b点溶液中各微粒浓度关系为2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)D.中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,后者多
解析 由图可知,醋酸和氢氧化钠中和滴定的滴定终点为碱性,而石蕊的变色pH范围为5~8,不选其做指示剂,应选用酚酞做指示剂,A项错误;c点时,溶液呈中性,则有c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则
b点时的溶质为等量的CH3COOH和CH3COONa,存在着质子守恒2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),C项正确;由于醋酸是弱电解质,在水溶液中部分电离,则相同体积、相同pH的醋酸和盐酸前者物质的量更大,故中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,前者多,D项错误。
归纳总结 1.分析步骤首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸或碱的强弱,这对于判断滴定终点至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点时溶液的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
2.滴定过程中的定量关系(1)电荷守恒关系在任何时候均存在;(2)物料守恒可以根据加入酸的物质的量或加入碱的物质的量进行确定,但不一定为等量关系。
深度指津 酸碱中和滴定中常见的误差分析(1)要依据公式c(待测)= 来判断。c(标准)和V(待测)在误差分析时是定值,因此只需分析各种原因使得所耗标准液体积V(标准)变大或变小即可,V(标准)变大,则c(待测)偏高,V(标准)变小,则c(待测)偏低。(2)以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例,常见的因操作不正确而引起的误差分析如下:
1.3种式子H2O H++OH-;KW=c(H+)·c(OH-);pH=-lgc(H+)。2.3种关系(1)c(H+)>c(OH-),溶液呈酸性;(2)c(H+)=c(OH-),溶液呈中性;(3)c(H+)
相关课件
这是一份2024年高考化学一轮总复习 第7单元 第2讲 水的电离和溶液的pH 课件,共60页。PPT课件主要包含了×10-14,稀的电解质溶液,-lgcH+,表面皿,玻璃棒,标准比色卡,溶液pH的计算方法,标准液的体积,滴定终点,酸式滴定管等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第8章 第47讲 水的电离和溶液的pH,共60页。PPT课件主要包含了高考化学一轮复习策略,水的电离和溶液的pH,归纳整合,专项突破,溶液的酸碱性与pH,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习8.2水的电离和溶液的ph课件









