



高考化学一轮总复习优化设计 第九单元 第2节 物质的检验、分离和提纯课件PPT
展开
这是一份高考化学一轮总复习优化设计 第九单元 第2节 物质的检验、分离和提纯课件PPT,共59页。PPT课件主要包含了必备知识自主预诊,关键能力考向突破,答案BC,2特殊检验法,网络构建,核心速记等内容,欢迎下载使用。
知识梳理1.物质分离、提纯的区别(1)物质的分离。将混合物中的各组分分离开来,获得几种纯净物的过程。(2)物质的提纯。将混合物中的杂质除去而得到纯净物的过程,又叫混合物的净化或除杂。
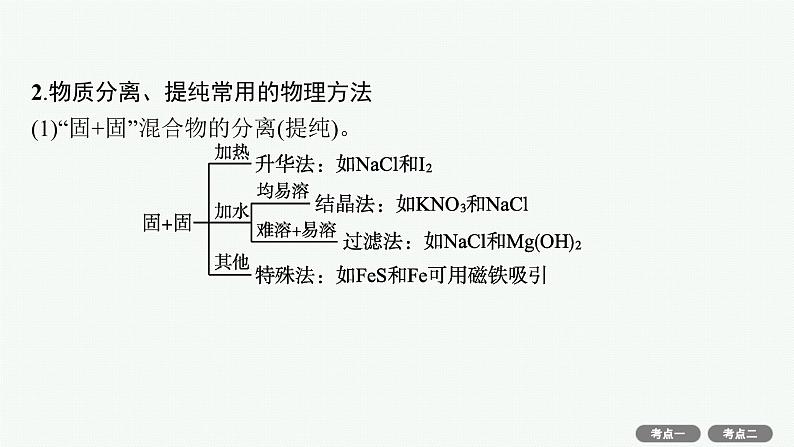
2.物质分离、提纯常用的物理方法(1)“固+固”混合物的分离(提纯)。
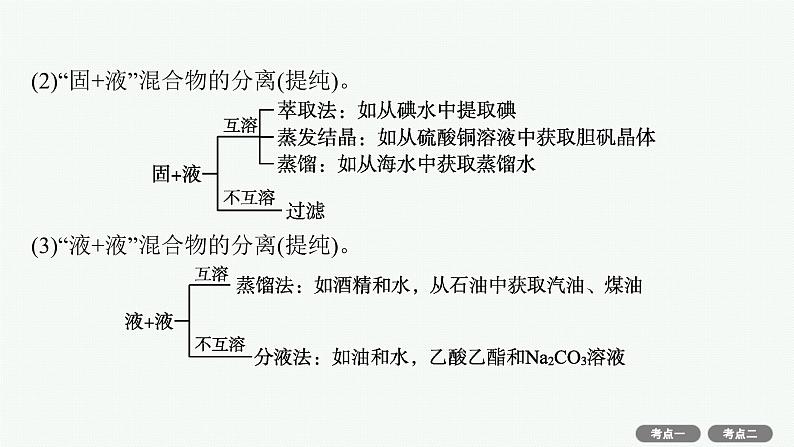
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
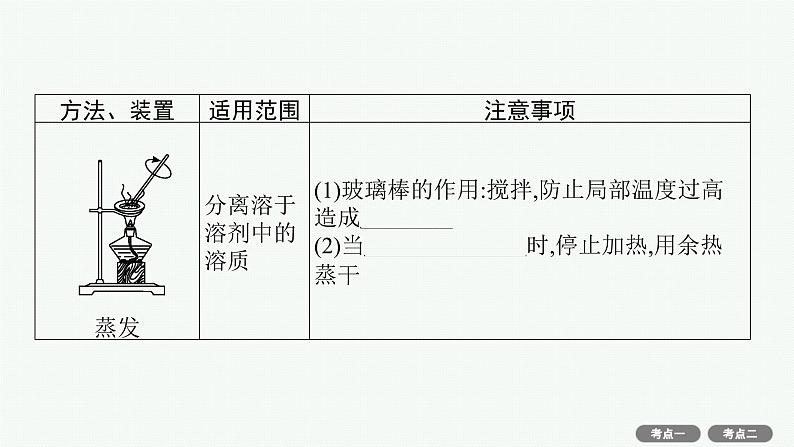
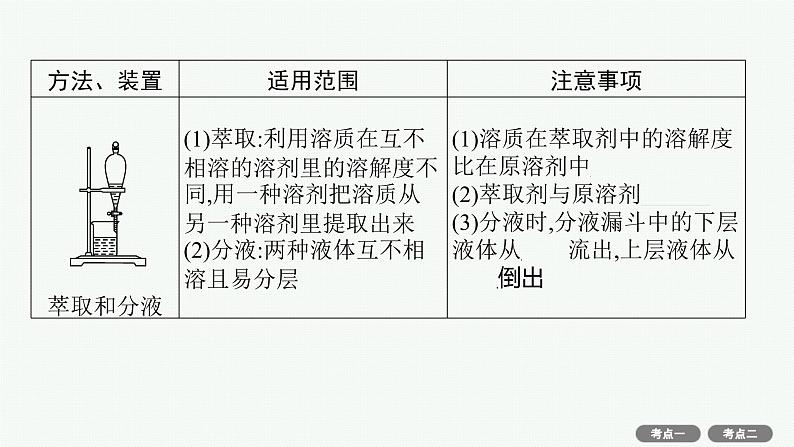
(4)物质分离、提纯常用物理方法的装置及注意事项。
3.物质分离、提纯的化学方法
微点拨提纯的“四个原则”及“四个必须”(1)“四个原则”:一是不增加新的杂质;二是不减少被提纯物质;三是被提纯物质与杂质易分离;四是被提纯物质易复原。(2)“四个必须”:一是除杂试剂必须过量;二是过量试剂必须除尽;三是除杂途径必须最佳;四是除去多种杂质时必须考虑加入试剂的先后顺序。
自我诊断1.判断正误,正确的打“√”,错误的打“×”。(1)可用分液漏斗分离出乙酸与乙醇反应的产物。( ) (2)利用如图操作可分离Na2CO3溶液与CH3COOC2H5。( )
(3)除去KCl中的MnO2:蒸发结晶。( )(4)除去碘中的NaCl:加热、升华。( )(5)除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2并过滤。( )(6)除去NaCl溶液中少量的Na2S:加入AgCl后再过滤。( )(7)除去氯化钠固体中的少量纯碱:加入足量氯化钙溶液,过滤、蒸发、结晶。( )(8)除去石英中的少量碳酸钙:用稀盐酸溶解后过滤。( )
答案 (1)× (2)× (3)× (4)√ (5)√ (6)√(7)× (8)√
2.(1)除去粗盐中的Ca2+、Mg2+、S 杂质离子,应依次加入(写试剂化学式) 。 (2)过滤时所用到的玻璃仪器为 。 (3)蒸发时,能否将母液蒸干后,再停止加热? 。
答案 (1)BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3(2)烧杯、普通漏斗、玻璃棒(3)不能,如果将母液蒸干后再停止加热,蒸发皿的余热会使析出的晶体受热不均而飞溅,造成食盐损失和实验事故
考向1 物质分离、提纯的物理方法【典例1】 (2020山东化学,8)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )A.萃取振荡时,分液漏斗下口应倾斜向下B.分液时,应先将下层液体由分液漏斗下口放出C.分液后水相为无色,说明已达到分离目的D.蒸馏时选用直形冷凝管
答案 A 解析 A项,萃取振荡时,分液漏斗上口向下倾斜,A项错误;分液时,下层液体从下口放出,上层液体从上口倒出,B项正确;根据题意,Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,分液后,水相为无色,说明Al3+与[FeCl4]-已完全分离,C项正确。
对点演练1(2020福建福州质检)氯气氧化HBr提取溴的新工艺反应之一为:6H2SO4+5BaBr2+Ba(BrO3)2==6BaSO4↓+6Br2+6H2O,利用此反应和CCl4得到液溴的实验中不需要用到的实验装置是( )
答案 D 解析 萃取后得到Br2的CCl4溶液,分离出Br2时应选择蒸馏操作,故A正确;反应后的液体混合物除BaSO4沉淀时,应选择过滤操作,故B正确;萃取过滤后的混合液中的Br2,应选择加入CCl4,然后再进行分液操作,故C正确;坩埚主要用于灼烧固体及溶液的蒸发、浓缩或结晶,本实验不涉及此操作,故D错误。
考向2 物质分离、提纯的化学方法【典例2】 (双选)(2020山东化学,11)下列操作不能达到实验目的的是( )
解析 A项,苯酚能与NaOH溶液反应生成苯酚钠,苯与NaOH溶液不反应且会分层,然后通过分液进行分离;B项,盐酸易挥发出HCl,HCl能与苯酚钠反应生成苯酚,因而会干扰CO2与苯酚钠的反应,无法验证酸性:H2CO3>苯酚;C项,驱赶碱式滴定管中气泡的正确方法是使尖嘴部分向上弯曲,然后挤压胶管中的玻璃球;D项,配制新制Cu(OH)2悬浊液过程中,由于溶液显碱性,因此,应将CuSO4溶液滴加到2 mL 10%的NaOH溶液中。
对点演练2(2020海南高考调研测试)下列有关物质(括号内为杂质)的提纯方法正确的是( )A.丙烷(丙烯)——通入酸性高锰酸钾溶液B.苯(苯酚)——加入氢氧化钠,分液C.丙酸乙酯(丙酸)——加入稀硫酸D.甘油(水)——分液
答案 B 解析 丙烯与酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳,会引入新的杂质,A错误;苯不与氢氧化钠溶液反应,且难溶于水,苯酚与氢氧化钠溶液反应生成溶于水的苯酚钠,加入氢氧化钠溶液后分层,用分液的方法可以分离、提纯苯,B正确;丙酸乙酯在稀硫酸作用下,会发生水解反应生成丙酸和乙醇,C错误;甘油和水互溶,不能用分液的方法分离、提纯,D错误。
深度指津 分离、提纯题的答题步骤第一步:确定被提纯物质与除杂对象对比两者物理性质、化学性质的差异,利用差异性(溶解度差异、密度差异、熔沸点差异、与某些物质反应的差异性等),选择合适的分离原理或除杂试剂;除杂试剂除去杂质的同时,不消耗被提纯物质,不引入新的杂质。
第二步:选择合适的分离或除杂装置根据分离原理选择合适的分离装置(过滤、分液、蒸馏等);根据除杂试剂的状态及反应条件,选择合适的装置,液体试剂一般选洗气瓶,固体试剂一般用干燥管或U形管。第三步:综合分析,合理解答综合分析物质分离是否完全,被提纯物质中的杂质是否被除去。
知识梳理1.气体的检验(1)可燃性气体的检验。
(2)酸性气体的检验。
(3)碱性气体的检验(NH3)。
(4)还原性气体的检验。
(5)氧化性气体的检验。
2.常见阳离子检验(1)常规检验法。①用NaOH溶液能检验出Cu2+、Fe3+、Fe2+、Al3+、N 。
②焰色试验:用焰色试验可检验出溶液中的K+和Na+。
[注意]①检验Fe2+和Fe3+时,一般应用特殊检验法。②注意不能利用酸性KMnO4溶液检验FeCl2溶液中的Fe2+,因为KMnO4(H+)会氧化Fe2+也会氧化Cl-。
3.常见阴离子检验(1)利用酸碱指示剂检验。
(2)利用盐酸和其他试剂检验。
(3)利用AgNO3(HNO3酸化)溶液检验。
(4)利用某些特征反应检验。I-→滴入淀粉溶液和新制氯水,溶液变蓝色。[注意]①HC 与C 均会与盐酸反应产生CO2,所以要注意区分。②I-的特征反应检验方法中,氧化剂可以是氯水,也可以是Fe3+或H2O2等物质。
微点拨 物质检验的基本原则和方法物质检验的“三原则”:一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
(3)显现特殊颜色,如Fe3+、苯酚的检验;(4)焰色试验,如Na+、K+的检验。
4.有机化合物的检验
自我诊断1.判断正误,正确的打“√”,错误的打“×”。
(5)某溶液的焰色试验呈黄色,则溶液中一定有钠元素,不能确定是否有钾元素。( )(6)与银氨溶液反应能够产生银镜的物质一定是醛类物质。( )
答案 (1)√ (2)× (3)× (4)× (5)√ (6)×
2.怎样检验溶液中既有Cl-,又有S ?
答案 向试液中先加足量的Ba(NO3)2溶液,生成白色沉淀,过滤后,再向滤液中加入AgNO3溶液,仍有白色沉淀,且白色沉淀不溶于稀硝酸,说明溶液中既有Cl-,又有S 。
考向1 物质的检验【典例1】 (双选)(2020海南高考调研测试)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
答案CD 解析 产生的白色沉淀可能是氯化银,A错误;产生蓝色沉淀,说明相同条件下Cu(OH)2溶解度更小,更容易沉淀,二者为同类型沉淀,溶解度越小,溶度积就越小,所以Ksp[Mg(OH)2]>Ksp[Cu(OH)2],B错误;根据实验现象说明有I2生成,少量氯水先氧化了I-,说明I-的还原性更强,C正确;浊液变澄清,说明苯酚与碳酸钠反应生成了苯酚钠,即C 夺取了苯酚的氢离子,所以结合氢离子的能力:
相关课件
这是一份2022年高考总复习 化学 模块4 第十单元 第2节 物质的检验、分离和提纯课件PPT,共60页。PPT课件主要包含了先变浑浊后变澄清,出现红色,白色沉淀,答案A等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习第9单元化学实验基础第2节物质的检验分离和提纯课件
这是一份高考化学总复习专题十六物质的检验、分离和提纯完美课件PPT,共60页。PPT课件主要包含了考点52,考点53,试做真题,高手必备,萃取高招,对点精练,方案Ⅱ,常见气体检验等内容,欢迎下载使用。









