





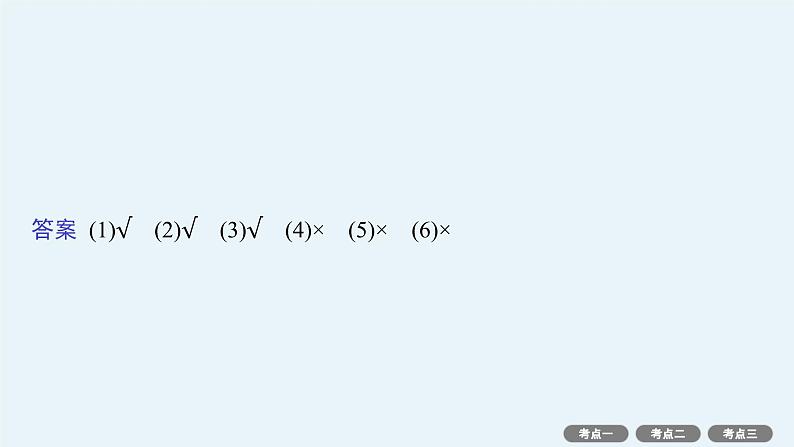
高考化学一轮总复习优化设计 第七单元 第3节 化学平衡常数 化学反应的方向课件PPT
展开
这是一份高考化学一轮总复习优化设计 第七单元 第3节 化学平衡常数 化学反应的方向课件PPT,共60页。PPT课件主要包含了必备知识自主预诊,浓度幂之积,关键能力考向突破,答案BC,答案A,答案AD,答案B,平衡点,答案C,网络构建等内容,欢迎下载使用。
知识梳理1.定义在一定温度下,一个可逆反应达到化学平衡时,生成物 与反应物 的比值是一个常数,用符号 表示。 2.表达式对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),在一定温度下达到平衡时:平衡常数K= (固体和纯液体的浓度视为常数)。
3.意义(1)K的大小反映了化学反应进行的程度。K越大,反应物的转化率越 ,正反应进行的程度越 。当K≥105时,该反应就进行得基本完全了。 (2)K的大小只能预示某可逆反应向某方向进行的最大限度,不能预示反应达到平衡所需要的时间。(3)K只受 影响,与反应物或生成物的浓度变化无关,与压强变化无关。
4.应用(1)利用化学平衡常数,可判断反应是否达到平衡或反应进行的方向。对于化学反应aA(g)+bB(g) cC(g)+dD(g)的任意状态,浓度商Q= 。 QK,反应向 反应方向进行。
(2)利用K可判断反应的热效应:若升高温度,K增大,则正反应为 热反应;若升高温度,K减小,则正反应为 热反应。 (3)计算转化率:利用平衡常数计算转化率的主要途径是利用温度不变时平衡常数不变,可列方程求解。(4)计算相关反应的平衡常数。若只是反应方向改变,则平衡常数变为其倒数;若只是方程式中各物质的化学计量数等倍扩大(变为原来n倍)或缩小程
自我诊断1.判断正误,正确的打“√”,错误的打“×”。(1)平衡常数发生变化,化学平衡必定发生移动。( )(2)平衡常数和转化率都能体现可逆反应进行的程度。( )(3)其他条件不变,使用不同催化剂,反应的平衡常数不变。( )(4)对某一可逆反应,升高温度则化学平衡常数一定变大。( )(5)改变条件,使反应物的平衡转化率都增大,该可逆反应的平衡常数一定增大。( )(6)反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K增大。( )
答案 (1)√ (2)√ (3)√ (4)× (5)× (6)×
2.在一定温度下,已知以下三个反应的平衡常数:反应①:CO(g)+CuO(s) CO2(g)+Cu(s) K1反应②:H2(g)+CuO(s) Cu(s)+H2O(g) K2反应③:CO(g)+H2O(g) CO2(g)+H2(g) K3(1)反应①的平衡常数表达式为 。 (2)反应③的K3与K1、K2的关系是K3= 。
考向1 化学平衡常数表达式及其影响因素【典例1】 (双选)(2020陕西西安铁一中学质检)O3是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生的反应如下:
下列叙述正确的是( )A.降低温度,总反应K减小B.K=K1+K2C.适当升温,可提高消毒效率D.压强增大,K2减小
对点演练1(2020湖南长沙八校联考)将一定量的SO2(g)和O2(g)分别通入体积为2 L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:
下列说法中不正确的是( )A.x=、T2的关系:T1>T2C.K1、K2的关系:K2>K1D.实验1在前6 min的反应速率v(SO2)=0.2 ml·L-1·min-1
解析 根据题中信息可列“三段式”: 2SO2(g)+O2(g) 2SO3(g)n(起始)/ml 4 2n(转化)/ml 4-x 2-0.8n(平衡)/ml x0.8(4-x)∶(2-0.8)=2∶1解得:x=1.6同理,解得y=0.2
由于2SO2(g)+O2(g) 2SO3(g)是放热反应,温度越高,反应正向进行的程度越小,根据x、y可以判断出T1>T2,K1v(逆)
对点演练2(1)某温度下,反应2SO2(g)+O2(g) 2SO3(g)中SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 ml SO2和1.0 ml O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A) (填“>”“x;在相同压强下,升高温度(T1>T2),C的百分含量降低,说明升高温度平衡逆向移动,该反应的正反应为放热反应。增大压强平衡向正反应方向移动,A的百分含量减小,与图像不符,A错误。增大压强平衡向正反应方向移动,B的百分含量减小,与图像不符,B错误。由于反应容器的容积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,C错误。升高温度,平衡向逆反应方向移动,混合气体的物质的量增多,质量不变,平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,平衡混合气的平均摩尔质量增大,与图像符合,D正确。
规律方法 有关“拐点”图像的分析方法同一可逆反应,若反应条件不同,达到平衡所用的时间也可能不同,反映到图像出现“拐点”的时间也就有差异。图像中先出现“拐点”的反应先达到平衡,即反应所处的外界条件(温度、压强、浓度)相对要高一些,或者是加入了催化剂。
考向3 由平滑曲线组成的图像【典例3】 T ℃时,在一固定容积的密闭容器中发生反应A(g)+B(g) C(s) ΔHb>aB.若T2>T1,则正反应一定是放热反应C.达到平衡时A2的转化率大小为b>a>cD.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
答案 A 解析 在温度和n(A2)起始不变时,只增大n(B2)起始,相当于平衡向正反应方向移动,AB3的物质的量会增大,则AB3的物质的量大小为c>b>a,故A正确;由图像可知,在n(A2)起始和n(B2)起始保持不变时,T2时AB3的平衡体积分数比T1时的大,若T2>T1说明升温使平衡向正反应方向移动,则正反应一定是吸热反应,故B错误;相同温度下,增大一种反应物的浓度会使其他反应物的转化率增大,增大B2的量,A2的转化率增大,则达到平衡时A2的转化率大小为c>b>a,故C错误;温度越高,反应速率越大,若T2>T1,达到平衡时b、d点的反应速率为vb>vd,故D错误。
知识梳理1.自发反应(1)含义:在温度和压强一定的条件下无需借助外力就能自发进行的反应称为自发反应。(2)特点:①体系趋向于从高能状态转变为低能状态(体系对外部做功或释放热量)。②在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2.判断化学反应方向的依据
3.合成氨反应条件的原理分析(1)反应原理:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·ml-1。(2)反应特点:
合成氨反应—可逆性:反应为可逆反应
—体积变化:正反应是气体体积减小的反应
—焓变:ΔHp2>p3。(4)由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
相关课件
这是一份2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第24讲化学平衡常数化学反应的方向课件,共60页。PPT课件主要包含了化学平衡,浓度幂之积,答案D,答案A,56×105,答案C,答案B,反应Ⅰ,无需借助外力,混乱程度等内容,欢迎下载使用。
这是一份新教材适用2024版高考化学一轮总复习第7章化学反应速率与化学平衡第22讲化学平衡常数化学反应的方向与调控课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,化学平衡,浓度幂之积,反应物本身,催化剂,1计算步骤,L·mol-1等内容,欢迎下载使用。
这是一份2024年高考化学一轮总复习 第6单元 第3讲 化学平衡常数 化学反应的方向 课件,共60页。PPT课件主要包含了考点一化学平衡常数,反应Ⅰ,Kp1·Kp2,混乱度,自发进行,表面积,催化剂,低温高压,SO2污染大气,②解题原则和方法等内容,欢迎下载使用。









