



所属成套资源:【期末模拟试卷】人教版(2019)高二化学选择性必修1-期末模拟测试套卷
【期末模拟测试】人教版(2019)高二化学选择性必修第一册:期末测试卷01
展开
这是一份【期末模拟测试】人教版(2019)高二化学选择性必修第一册:期末测试卷01,文件包含期末模拟测试人教版2019高二化学选择性必修第一册期末测试卷01全解全析doc、期末模拟测试人教版2019高二化学选择性必修第一册期末测试卷01考试版doc等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。
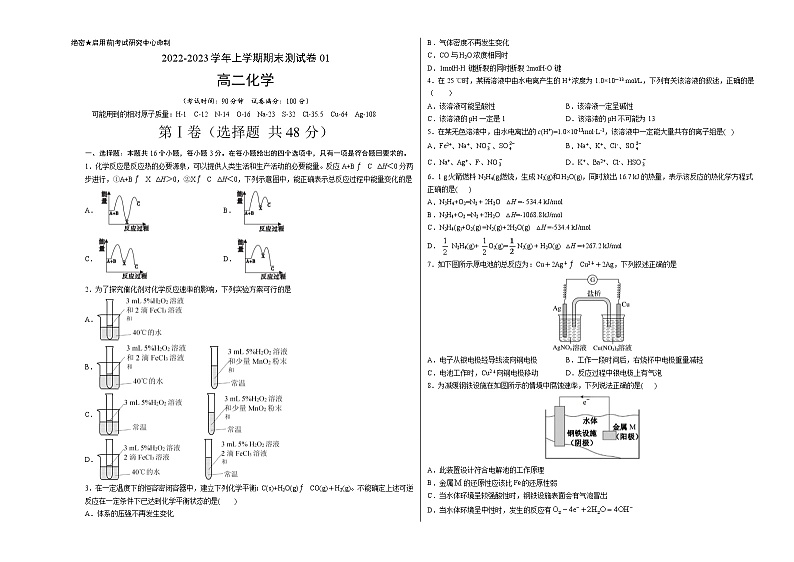
2022-2023学年上学期期末测试卷01高二化学·全解全析12345678910111213141516DCCABCBCABADCDCD1.【答案】D【详解】总反应焓变小于0,为放热反应,所以A+B的能量高于C,第一步反应焓变大于0为吸热反应,所以A+B的能量低于X,第二步反应焓变小于0为放热反应,所以X的能量高于C,综上所述图像D符合,故答案为D。2.【答案】C【详解】A.没有参照物,所以无法判断,故A项不选;B.两实验的催化剂、温度都不同,所以无法判断,故B项不选;C.两个实验不同点只有是否具有催化剂,所以能够判断催化剂对化学反应速率的影响,故C项选;D.两实验温度不同,其目的是探究温度对化学反应速率的影响,故D项不选;故答案为C。3.【答案】C【分析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。【详解】A. 该反应是气体体积增大的反应,反应过程中压强增大,当体系的压强不再发生变化时,说明反应到达平衡,故A不选;B. 该反应是气体体积增大的反应,反应过程中气体总质量增大,体积不变,密度增大,当气体密度不再发生变化时,说明反应到达平衡,故B不选;C. 反应C(s)+H2O(g)CO(g)+H2(g)中,每生成1mol CO(g)的同时,生成1mol H2(g),CO与H2O浓度始终相等,当CO与H2O浓度相同时,不能说明反应到达平衡,故C选;D. 1 mol H−H键断裂等效于生成2 mol H−O键的同时断裂2 mol H−O键,说明正反应速率等于逆反应速率,说明反应达平衡状态,故D不选;故选C。4.【答案】A【详解】25℃时,溶液中由水电离产生的c(H+)水为10-13mol/L,则由水电离产生的c(OH-)水也为10-13mol/L;若溶液呈强酸性,根据Kw=c(H+)∙c(OH-)水,可知溶液中c(H+)为10-1mol/L,由于c(H+)水与c(H+)相比,可以忽略不计,故该酸性溶液pH为1;若溶液呈强碱性,则溶液中H+仅来自于水的电离,c(H+)=c(H+)水=10-1mol/L,根据Kw=c(H+)∙c(OH-),可知溶液中c(OH-)为10-1mol/L,故该碱性溶液pH为13;综上所述,该溶液可能是酸性,也可能是碱性,pH可能为1,也可能为13,故A正确。故选A。5.【答案】B【详解】水电离出的c(H+)=1.0×10-13mol·L-1,说明水的电离受到抑制,则可能是酸溶液也可能是碱溶液;A.亚铁离子不能在无色溶液中大量存在,且酸性溶液中硝酸根会把亚铁离子氧化,故A不符合题意;B.酸性或碱性环境中四种离子相互之间均不反应,且无色,可以大量共存,故B符合题意;C.F-不能在酸性溶液中大量存在,Ag+不能在碱性溶液中大量存在,故C不符合题意;D.亚硫酸氢根既能和氢离子反应也能和氢氧根反应,酸性或碱性溶液中均不能大量共存,故D不符合题意;综上所述答案为B。6.【答案】C【详解】A.没注明物质的聚集状态,选项A错误;B.没注明物质的聚集状态,选项B错误;C.1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,选项C正确;D.反应为放热,焓变为负值,选项D错误;答案选C。7.【答案】B【分析】原电池的总反应为:Cu+2Ag+Cu2++2Ag,Cu极作负极,电极方程式为:Cu-2e-= Cu2+,Ag极作正极,电极方程式为:2Ag++2e-=2Ag,以此解答。【详解】A. Cu为负极Ag为正极,电子从负极Cu经导线流向正极Ag,故A错误;B. 右烧杯发生电极反应Cu-2e-= Cu2+,电极重量减轻,故B正确;C. 电池工作时,阳离子向正极移动,Cu2+向银电极移动,故C错误;D. Ag极作正极,电极方程式为:2Ag++2e-=2Ag,没有气泡产生,故D错误;故选B。8.【答案】C【详解】A.该装置为牺牲阳极的阴极保护法,符合原电池的工作原理,A错误;B.金属的还原性应该比的还原性强,才能优先失去电子,从而保护铁不被腐蚀,B错误;C.当水体环境呈较强酸性时,H+向钢铁设施一极移动,得到电子生成氢气,钢铁设施表面会有气泡冒出,C正确;D.当水体环境呈中性时,发生吸氧腐蚀,O2得到电子,反应为,D错误;答案选C。9.【答案】A【详解】A.根据反应热键能计算,反应(2)的 △H= ,解得x=,A项正确;B.根据盖斯定律,由反应 可得:H2O(g)=H2O(l) △H=kJ/mol,水从气态到液态、从液态到固态的变化均是熵减的过程,故正反应为熵减小的反应,B项错误;C.当有4NA个C‒H键断裂时,1molCH4反应,若生成H2O(l)放出akJ热量,若生成H2O(g),则放出bkJ热量,C项错误;D.CH4燃烧为放热反应,a、b均小于零。且反应物相同时,生成同种液态物质放出的热量比生成等量的气态物质放出的热量多,故a<b。根据燃烧热的定义,燃烧热所生成的产物一定是稳定的。则水应为液态,故甲烷燃烧热为akJ/mol;D项错误;答案选A。【答案】B【分析】溶液中存在平衡,、、,由于常温下溶液,说明电离大于水解,据此解答问题。【详解】A.溶液中会发生水解和电离,因此,A错误;B.由上述分析可知,溶液中的电离大于水解,但电离、水解均是少量的,因此,B正确;C.溶液中存在电荷守恒:,C错误;D.溶液中加入少量溶液发生反应:,D错误;答案选B。11.【答案】A【详解】A.该反应前后气体总质量减小,混合气体的物质的量不变,则混合气体平均摩尔质量在反应前后减小,当容器中混合气体的平均摩尔质量不再变化时,正逆反应速率相等,反应达到平衡状态,故A正确;B.平衡后加入X,平衡正向移动,但是消耗X的增加量小于加入X的量,所以X转化率减小,但是Y转化率增大,故B错误;C.焓变只与反应物和生成物能量差有关,与反应条件、平衡移动方向无关,故C错误;D.W是固体,不影响化学反应速率,所以平衡后加入少量W,逆反应速率不变,故D错误;故答案选A。12.【答案】D【详解】A. CO的燃烧热为283 kJ·mol−1,单位错了,A错误;B.图中的CO(g)+O2(g)系数不等于方程式的化学计量数,不能表示由1 mol CO生成CO2的反应过程和能量关系,B错误;C.ΔH跟化学计量数成正比,化学计量数扩大2倍,ΔH也扩大2倍,ΔH变为−452 kJ·mol−1,但是选项中CO2为固态,变化为气体二氧化碳需要吸热,焓变放热是负值,ΔH > −452 kJ·mol−1,C错误;D.根据盖斯定律,式①÷2+式②可以求出Na2O2(s)+CO(g)=Na2CO3(s)的反应热,D正确;故选D。13.【答案】C【详解】A.升高温度,NO浓度增大,平衡逆向移动,逆向是吸热个,正向为放热反应,故A错误;B.该反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,因此K2<K1,故B错误;C.在T2℃时,若反应体系处于状态D,D向平衡方向移动,浓度减低,则为正向移动,因此υ正>υ逆,故C正确;D.该反应是等体积反应,B、D温度相同,物质的量相同,因此p(D)=p(B),C、D物质的量相等,温度C大于D点,因此压强p(C)>p(D),故D错误。综上所述,答案为C。14.【答案】D【详解】A. 固体氢氧化钠溶于水的过程中也放出一定的热量,故用固体氢氧化钠与稀盐酸反应来探究中和反应中能量的变化情况,显然不合理,故A错误;B. 稀硝酸可以把BaSO3氧化成BaSO4,不能说明原Na2SO3溶液已变质,故B错误;C. 向pH=3的醋酸溶液中,加入醋酸铵溶液,使醋酸的电离平衡逆向移动,氢离子浓度减小,溶液pH增大,溶液仍然呈酸性,该现象不能说明醋酸铵溶液呈碱性,故C错误;D. 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀,说明氢氧化镁沉淀转换成了蓝色的氢氧化铜沉淀,根据沉淀转化的原则可知,Ksp[Mg(OH)2]>Ksp[Cu(OH)2],故D正确;故选D。15.【答案】C【分析】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,由于H2SO3是二元酸,滴定过程中存在两个化学计量点,滴定反应为:NaOH+H2SO3═NaHSO3+H2O,NaHSO3+NaOH═Na2SO3+H2O,完全滴定需要消耗NaOH溶液的体积为80mL,结合溶液中的守恒思想判断分析。【详解】A.W点时,c()=c(H2SO3),pH=2,则Ka1= c(H+)=10-2,Y点时,c()=c(),pH=7.19,Ka2= c(H+)=10-7.19,H2SO3的=1×105.19,故A错误;B.根据分析,第一化学计量点时,溶液中恰好存在NaHSO3,根据图象,此时溶液中c(NaHSO3)==0.05mol/L,溶液pH=4.25,所以0.05mol/L NaHSO3溶液的pH=4.25,故B错误;C.根据图象,Y点为第二滴定点,溶液中c()=c(),根据电荷守恒,c(Na+)+c(H+)=c(OH−)+c()+2c(),由于c()=c(),所以3c()=c(Na+)+c(H+)−c(OH−),故C正确;D.Z点为第二化学计量点,此时溶液中恰好存在Na2SO3,溶液显碱性,表明会水解,考虑水也存在电离平衡,因此溶液中c(OH−)>c(),故D错误;答案选C。16.【答案】D【详解】A.电解池左侧发生反应Fe3+→Fe2+,左侧是阴极,电源a端为负极,故A正确;B.Fe的价电子排布式是3d64s2,Fe2+的电子排布式为[Ar]3d6,故B正确;C.根据图示,b是阳极,阳极发生的电极反应式为2HCl-2e-=2H++Cl2,故C正确;D.根据电子守恒,电路中转移1mol电子,需要消耗0.25mol氧气,标准状况下的体积是5.6L,故D错误;选D。17.【答案】(除特别说明,每空2分)减小(1分) 不变(1分) NO2(g)+CO(g)=CO2(g)+NO(g) =-234kJ·mol-1 CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) =-764.7kJ·mol-1 N2(g)+O2(g)=2NO(g) =+183kJ·mol-1 【详解】(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234 kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g) =-234 kJ•mol-1,故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g) =-234 kJ•mol-1;(2)依据盖斯定律计算(②×3-①×2+③×2)得到CH3OH(l)+O2(g)=CO2(g)+2H2O(l) =3×(-192.9kJ•mol-1)-2×(+49.0kJ•mol-1)+2×(-44 kJ•mol-1)=-764.7 kJ•mol-1;故答案为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l) =-764.7 kJ•mol-1;(3)由题干图示可知,该反应中的反应热=(945+498)kJ•moL-1-2×630 kJ•moL-1=+183 kJ•moL-1,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g) =+183 kJ•moL-1,故答案为:N2(g)+O2(g)=2NO(g) =+183 kJ•moL-1。18.【答案】(每空2分) Ⅱ 60% 0.045 【分析】生成氢气的反应可由图、铁的性质找到;计算,则是落实到具体的反应方程式、运用三段式、从图中获取数据信息、结合转化率的定义、平衡常数的定义、分压的定义进行即可;【详解】(1)①由图知,在300°C时铁与水蒸气反应产生H2,化学方程式为。②当镍粉用量增加10倍后,甲酸的产量迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是II。(2)反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g),反应II:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),当在1L恒容密闭容器中充入1molCO2和4molH2,由图知,T1时,反应Ⅰ分别生成0.2mol甲烷、反应Ⅱ生成0.2mol乙烯,则 ,,则T1℃时,CO2的转化率。T1℃平衡时, , , , ,反应I的平衡常数 ;(3) 对反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g),正反应为放热反应,温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH;T4温度时,m=3时,设n(CO2)=3mol,n(H2)=9mol,列三段式如下: , ,3−2x=x,解得x=1mol,则乙醇所占的物质的量分数为 ,反应达到平衡时物质d的分压p(d)=。19.【答案】(方程式2分,其余每空1分)正 d 2Cl-+2H2O2OH-+H2↑+Cl2↑ 负 4OH-- 4e-=2H2O+O2↑ 变小 变浅 铜 5.4 【详解】(1)①由钠离子的移动方向可知,A电极为阳极,与直流电源正极相连,故答案为;正;②由电解食盐水装置图可知,钠离子移向右边,B电极为阴极,与直流电源负极相连,水在阴极上得到电子发生还原反应生成氢气,同时破坏水的电离平衡,在阴极区云集大量氢氧根离子,则氢氧化钠溶液从图中d处流出,故答案为:d;③电解饱和食盐水时,反应生成氢氧化钠、氢气和氯气,反应的离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O2OH-+H2↑+Cl2↑;(2)①将直流电源接通后,F极附近呈红色可知,F为电解池的阴极,则B为电源的负极,C为电解池的阳极,水电离出的氢氧根离子在阳极失去电子分氧化反应生成氧气,电极反应式为4OH-- 4e-=2H2O+O2↑;甲池电解硫酸铜溶液,电解时反应生成硫酸、铜和氧气,溶液中氢离子浓度增大,溶液的pH减小;氢氧化铁胶粒带正电荷,向阴极Y移动,则阳极X附近的颜色逐渐变浅,故答案为:负;4OH-- 4e-=2H2O+O2↑;减小;变浅;②由图可知,G为电镀池的阳极,则丙装置给铜件镀银时,H为镀件铜;当乙中溶液的OH-浓度为0.1mol/L(此时乙溶液体积为500mL)时,电路中转移电子数目为0.1mol/L×0.5L=0.05mol,则铜镀件上析出银的质量为0.05mol×108g/mol=5.4g,故答案为:铜;5.4。 20.【答案】(除特殊说明,其余每空2分)571.4 将HCO转化为CO,增大溶液中CO的浓度 温度过高将会导致NH4HCO3的分解及氨水的分解挥发 取最后一次浸取液,向其中滴加几滴酚酞,溶液不变红 氨水 (1分) SrSO4+2C=SrS+2CO2↑(或SrSO4+4C=SrS+4CO↑) 取适量的黑灰用90℃的热水浸取2~3次,将产生的气体用NaOH溶液充分吸收,所得浸取液合并后滴加稍过量的3mol·L-1H2SO4,将所得沉淀过滤、洗涤、烘干 【分析】天青石精矿(主要含SrSO4,还含有少量SiO2、CaSO4、BaSO4),加入碳酸氢铵溶液和氨水浸取,可将SrSO4转化为SrCO3,过滤后滤渣含有SiO2、CaCO3、BaSO4、SrCO3滤液中含有NH,滤渣经过焙烧,“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液,再和第一步浸取的滤液反应生成SrSO4,以此解答。【详解】(1)室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则溶液中= ==571.4,故答案为:571.4;(2)一水合氨可以和碳酸氢根反应生成碳酸根,浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是:将HCO转化为CO,增大溶液中CO的浓度;NH4HCO3加热易分解,温度过高将会导致NH4HCO3的分解及氨水的分解挥发,所以“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,故答案为:将HCO转化为CO,增大溶液中CO的浓度;温度过高将会导致NH4HCO3的分解及氨水的分解挥发;(3) SrO粗品已经浸取完全时,浸取后的溶液中不再有Sr(OH)2,取最后一次浸取液,向其中滴加几滴酚酞,溶液不变红说明浸取完全,故答案为:取最后一次浸取液,向其中滴加几滴酚酞,溶液不变红;(4)第一步浸取滤液中含有NH,在沉淀过程中会生成NH3H2O,可循环利用,故答案为:氨水;(5)①SrSO4与C发生氧化还原反应生成SrS和二氧化碳或一氧化碳,根据得失电子守恒和质量守恒配平方程式为:SrSO4+2C=SrS+2CO2↑(或SrSO4+4C=SrS+4CO↑),故答案为:SrSO4+2C=SrS+2CO2↑(或SrSO4+4C=SrS+4CO↑);②由图可知,90℃是Sr(OH)2的浸取率最高,取适量的黑灰用90℃的热水浸取2~3次,将产生的气体用NaOH溶液充分吸收,所得浸取液合并后滴加稍过量的3mol·L-1H2SO4,将所得沉淀过滤、洗涤、烘干,故答案为:取适量的黑灰用90℃的热水浸取2~3次,将产生的气体用NaOH溶液充分吸收,所得浸取液合并后滴加稍过量的3mol·L-1H2SO4,将所得沉淀过滤、洗涤、烘干。21.【答案】(除特殊说明,其余每空2分)高温(1分) 2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol >(1分) 0.0125 (或0.167) 吸收(1分) c(H2)·c(I2) (1分)【分析】(1)由反应式①+②可得热化学方程式;(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应;②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压,计算出各组分气体的分压,从而求得平衡常数;(3)①第一步反应断裂共价键,吸收能量;②反应速率由慢反应决定,即v=k3c(H2I)•c(I),用第一步反应k1c(I2)=k-1c2(I),求出c(I)的表达式,用第二步的反应k2c(I)•c(H2)=k-2c(H2I),求出c(H2I)的表达式,代入即可求得v。【详解】(1)①反应①是气体物质的量增大的吸热反应,由,能自发进行的条件是高温,故答案为:高温;②由反应式①+②可得出反应Ⅱ的热化学方程式:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;故答案为:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应,该反应的△H>0,故答案为:>;②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压p,各气体的平衡分压:,,反应HI(g)H2(g)+I2(g)的平衡常数,故答案为:0.0125;(或0.167);(3)①第一步反应断裂共价键,吸收能量,故答案为:吸收;②反应速率由慢反应决定,即v=k3c(H2I)•c(I),第一步是快速平衡,k1c(I2)=k-1c2(I),可得,第二步也是快速平衡,k2c(I)•c(H2)=k-2c(H2I),可得,则速率方程为:,故答案为:c(H2)·c(I2)。
相关试卷
这是一份卷01——高二化学下学期期末模拟测试卷(鲁科版2019),文件包含卷01高二化学下学期期末模拟测试卷鲁科版2019解析版docx、卷01高二化学下学期期末模拟测试卷鲁科版2019原卷版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
这是一份期末模拟测试01——2022-2023学年高二化学下学期期末模拟测试(人教版2019选择性必修2),文件包含期末模拟测试01解析版docx、期末模拟测试01原卷版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份化学01卷(人教版2019选择性必修2+选择性必修3)——2022-2023学年高二下学期期末模拟测试卷,文件包含化学01卷人教版2019-全解全析docx、化学01卷人教版2019-考试版A4范围选择性必修2+选择性必修3docx、化学01卷人教版2019-参考答案docx、化学01卷人教版2019-答题卡docx等4份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。









