

山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题(有答案)
展开
这是一份山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题(有答案),共24页。试卷主要包含了本试卷分选择题和非选择题两部分,已知属于难溶于水、可溶于酸的盐,双极膜等内容,欢迎下载使用。
2022-2023学年度第一学期期末考试
高二化学试题(A)
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.答题前,考生务必将姓名、班级等个人信息填写在答题卡的指定位置。
3.考生作答时,请将答案正确填写在答题卡上。
可能用到的相对原子质量:
一、选择题:本题共10小题,每小题2分。每小题只有一个选项符合题目要求。
1.2022年4月16日9时56分,在太空遨游半年的神舟十三号飞船在东风着陆场平安降落.下列有关说法错误的是()
A.飞船的天线是用钛镍形状记忆合金制造的,低温下折叠,进入太空后在阳光照射下重新展开
B.载人飞船中的太阳能电池和储能电池均可将化学能转化为电能
C.返回舱表面的“烧蚀层”熔点很高,因此可以保护返回舱不因高温而烧毁
D.硅橡胶密封材料既耐低温又耐高温,在飞船上得到广泛应用
2.已知卤化银在水中的溶解是吸热过程。时,AgCl、AgBr在水中的沉淀溶解平衡曲线如图所示(X:Cl、Br),,。下列说法正确的是()
A.
B.代表AgBr在水中的沉淀溶解平衡曲线
C.升高温度,N点沿NP方向移动
D.的平衡常数
3.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是()
A.阳极发生将海水中的氧化生成的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的应及时通风稀释安全地排入大气
D.阳极表面形成的等积垢需要定期清理
4.已知属于难溶于水、可溶于酸的盐。常温下,用HCl调节浊液的pH,测得在不同pH条件下,体系中(X为或)与的关系如图所示。
下列说法错误的是()
A.代表与的变化曲线
B.的数量级为
C.a、c两点的溶液中均存在
D.c点的溶液中存在
5.溶洞水体中的与空气中的保持平衡,其水体中(X为、、或)与pH的关系如图所示。已知,下列说法错误的是()
A. B.线Ⅱ代表与pH的关系曲线
C. D.a点溶液中,
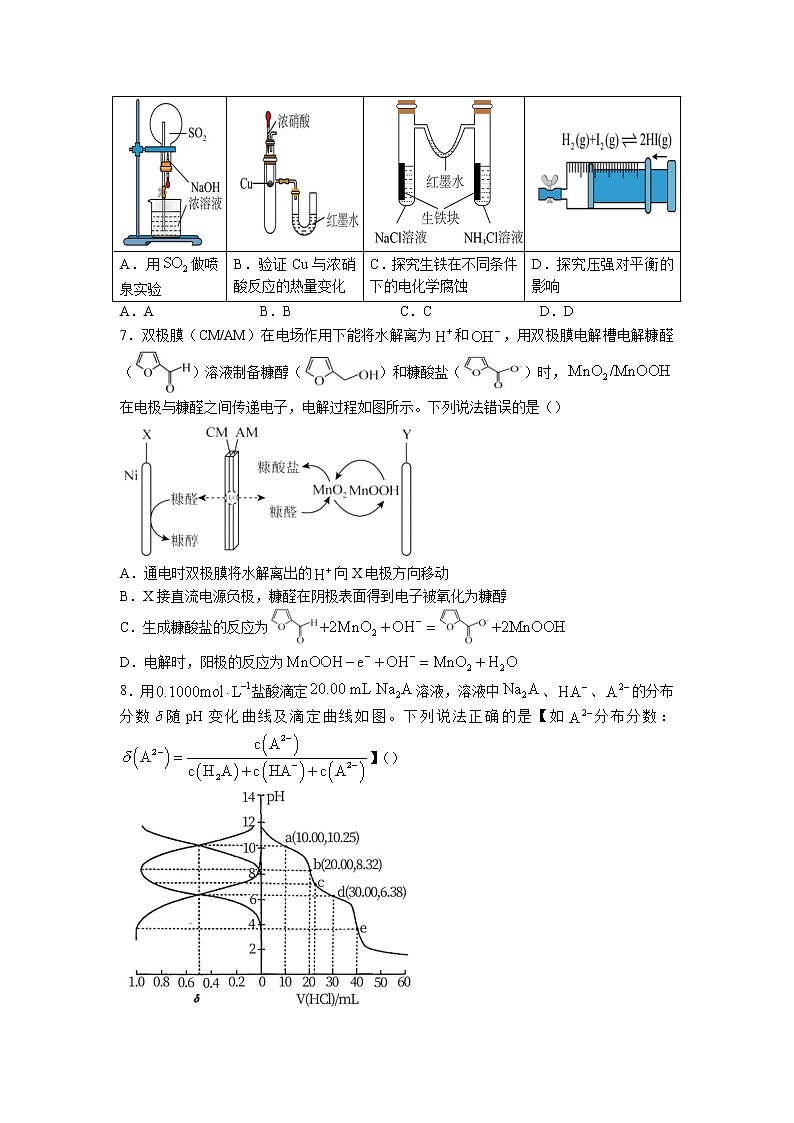
6.下列实验装置不能达到实验目的的是()
A.用做喷泉实验
B.验证Cu与浓硝酸反应的热量变化
C.探究生铁在不同条件下的电化学腐蚀
D.探究压强对平衡的影响
A.A B.B C.C D.D
7.双极膜(CM/AM)在电场作用下能将水解离为和,用双极膜电解槽电解糠醛()溶液制备糠醇()和糠酸盐()时,在电极与糠醛之间传递电子,电解过程如图所示。下列说法错误的是()
A.通电时双极膜将水解离出的向X电极方向移动
B.X接直流电源负极,糠醛在阴极表面得到电子被氧化为糠醇
C.生成糠酸盐的反应为
D.电解时,阳极的反应为
8.用盐酸滴定溶液,溶液中、、的分布分数随pH变化曲线及滴定曲线如图。下列说法正确的是【如分布分数:】()
A.的为 B.c点:
C.第一次突变,可选酚酞作指示剂 D.
9.一种以镍电极废料(含Ni以及少量、和不溶性杂质)为原料制备NiOOH的过程可表示为:
“酸浸”后溶液中的金属离子除外还有少量的和等,下列说法错误的是()
A.氧化性:
B.除杂过程仅为过滤操作
C.氧化过程中每生成1molNiOOH消耗
D.工业上也可电解碱性悬浊液制备NiOOH,加入一定量的KCl有助于提高生产效率
10.25℃时,向的中,以的速度逐滴加入的HCl溶液。如图为与时间(t)的关系图,其中一条线段为,另一条线段为。己知电离平衡常数,。下列说法不正确的是()
A.该酸碱滴定实验最宜用甲基橙作为指示剂
B.由图可推知:M点的pH约为9.3
C.使HCl溶液滴至1min时,由可推知:
D.适当升高温度(忽略的变化),Q点(与x轴交点)将向右移动
二、多选题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得四分,选对但不全的得2分,有选错的得0分。
11.钽酸锂()是功能材料领域的“万能”材料,具有良好的机械性能。某企业利用含钽废渣(主要含、及油脂等)制备钽酸锂的工艺流程如下:
已知:
①“钠盐和氧化物”中主要成分有、、等;
②正五价的钽元素具有一定的氧化性。
下列说法错误的是()
A.通空气目的只是氧化生成和
B.“滤渣Ⅰ”中主要成分是
C.“溶液Ⅱ”中最好将盐酸换为硫酸
D.实验室模拟“灼烧”时,主要仪器有瓷坩埚、酒精灯、玻璃棒等
12.为一元弱碱,常温下,将HCl气体通入水溶液中,混合溶液中pH与微粒浓度的对数值(lgc)的关系如图所示(忽略溶液体积的变化)。下列说法正确的是()
A.的数量级为
B.该体系中,
C.P点,
D.P点之后,溶液中可能存在
13.恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①;②。反应①的速率,反应②的速率,式中、为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的曲线。下列说法错误的是()
A.随c(X)的减小,反应①、②的速率均降低
B.体系中
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于时,总反应速率由反应②决定
14.25℃时,随pH变化如图所示,下列说法错误的是()
己知:(单位:)表示的溶解度。
A.饱和溶液中
B.己知,则水中
C.pH变化时,溶液中始终存在:
D.当时,
15.常温下,二元弱酸溶液中含磷物种的浓度之和为,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(),pOH表示OH的浓度的负对数。下列有关说法正确的是()
A.曲线①表示随pOH的变化
B.b点时,
C.d点溶液中:
D.溶液呈碱性是因为离子的水解程度大于其电离程度
三、非选择题:本题共5小题,共60分。
16.(12分)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤Ⅰ.的制备
步骤Ⅱ.产品中含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸;
③在上述锥形瓶中再加入2滴指示剂N,继续用盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸;
④平行测定三次,平均值为22.45,平均值为23.51。
己知:(i)当温度超过35℃时,开始分解。
(ii)相关盐在不同温度下的溶解度表()
温度/℃
0
10
20
30
40
50
60
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
11.9
15.8
21.0
27.0
6.9
8.2
9.6
11.1
12.7
14.5
16.4
29.4
33.3
37.2
41.4
45.8
50.4
55.2
回答下列问题:
(1)步骤Ⅰ中晶体A的化学式为________,晶体A能够析出的原因是________;
(2)步骤Ⅱ中“300℃加热”所选用的仪器是________(填标号);
A. B. C. D.
(3)指示剂N为__________,描述第二滴定终点前后颜色变化__________;
(4)产品中的质量分数为__________(保留三位有效数字);
(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则质量分数的计算结果__________(填“偏大”“偏小”或“无影响”)。
17.(12分)钪的价格昂贵,在地壳里的含量只有0.0005%。从铝土矿生产的副产品“赤泥”(主要成分为、、、)中回收钪,同时生产聚合硫酸铁铝具有极其重要的工业价值,一种工艺流程如下:
己知:钪离子可以在不同pH下生成。请回答以下问题:
(1)操作②的名称:________,操作①和操作②中都使用的玻璃仪器是________。
(2)加入铁粉的作用:________。
(3)生成聚合硫酸铁铝的离子方程式为________。
(4)钪是一种重要的稀土金属,化学性质非常活泼,但发现较晚主要是因为________。
(5)“反萃取”时若加入的氢氧化钠过量则沉淀会溶解。写与过量NaOH溶液反应生成
的含钪产物的化学方程式为________。
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数、pH的关系如图所示。若溶液中,“调pH”过程中控制,则调节pH后三价Sc的存在形式为________(填化学式)()。
(7)“脱水除铵”过程中,复盐分解得到,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则________(填数字)。
18.(12分)碳酸锶()难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量、、、等)制备高纯碳酸锶的工艺流程如下:
己知:Ⅰ.为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如下表所示。
化合物
近似值
回答下列问题:
(1)气体A的电子式为__________。
(2)“除钡、铅”时,pH过低会导致的利用率降低,原因为__________(用离子方程式解释);“还原”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为__________(填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的的原因为__________。
(5)“调”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为__________。
(6)己知:碳酸的电离常数、,则“碳化”时,反应的平衡常数__________(保留两位有效数字)。
(7)“系列操作”中包含“200℃烘干”操作,烘干过程中除蒸发水分外,还能够除去中的微量可溶性杂质,该杂质除外还可能为__________(填化学式)。
19.(12分)CO、加氢有利于缓解化石能源消耗,实现“碳中和”.该体系主要涉及以下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:
反应Ⅴ:
回答下列问题:
(1)上述反应中,__________(写出一个代数式即可)。
(2)密闭容器中,上述反应体系在一定条件下建立平衡后,下列描述正确的有__________(填标号)。
A.加入催化剂,可提高的平衡转化率
B.降低温度,反应Ⅱ的正反应速率增大,逆反应速率减小
C.增大CO的浓度,反应Ⅲ、Ⅳ的平衡均向左移动
D.恒温恒容充入氩气,反应Ⅰ、Ⅱ的平衡不移动
(3)恒容下,,并按照不同氢碳比投料,发生上述反应。图甲表示不同氢碳比时,的总平衡转化率随温度变化的关系;图乙表示氢碳比时,平衡后体系中、的选择性随温度变化的关系。
已知:的选择性,的选择性
①图甲中x________3(填“大于”“小于”或“等于”),其原因是________。
②Q点对应的体系中________mol;此时,转化了4mol,则反应的平衡常数__________(为以分压表示的平衡常数,分压总压物质的量分数,结果保留两位有效数字)。
(4)常温常压下,以Ag为催化剂,在酸性水溶液中将电催化还原为CO的反应历程如图所示:
①据图,CO和相比,__________(填化学式)更稳定。
②吸附在催化剂表面上的物种用*标注,图中第一步反应为,则第二步反应为__________。
20.(12分)晶体硅材料是最主要的光伏材料,随当前信息工程的发展,硅主要用于微电子技术。工业上将粗硅氯化、精馏后得到和的混合物然后用还原得到高纯硅。还原过程中发生的主要反应为:
i.
ii.
回答下列问题:
(1)己知:
还原生成的热化学方程式为__________。
(2)在、温度下,将、和加入体积固定的密团容器中,在催化条件下发生反应i、ii。测得的转化率及体系内的压强随时间的变化关系如图所示。
①温度下,反应达到平衡时的转化率_________。
②温度下,反应i的标准平衡常数的计算式为__________。
(己知:分压总压该组分物质的量分数,对于反应的,其中,、、、为各组分的平衡分压)。
③________0(填“>”或“
相关试卷
这是一份76,山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题,共8页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量等内容,欢迎下载使用。
这是一份山东省菏泽市鄄城县第一中学2023-2024学年高二上学期12月月考化学试题,共8页。
这是一份山东省菏泽第一中学2022-2023学年高二上学期期末考试化学试题(含答案),共22页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。









