
2022年中考化学备考一轮专题复习—-综合应用题附答案
展开
这是一份2022年中考化学备考一轮专题复习—-综合应用题附答案,共33页。试卷主要包含了中兴缺“芯”事件震惊国人,回答下列问题,请回答下列问题,金属在生产和生活中有广泛的应用等内容,欢迎下载使用。
2022年中考化学备考一轮专题复习—综合应用题附答案
1.(2022·天津滨海新·九年级期末)用下图装置在相应条件下完成下列实验:
(1)探究燃烧条件:B处盛木炭粉。
①由A处通N2一段时间后,加热B,B、C无明显变化。
②待B冷却至室温,由A处通入O2一段时间,B、C无明显变化。
③由A处通入O2,加热B,一段时间后木炭粉燃烧。
结论:由①和③可知燃烧需要__________。由②和③可知燃烧需要__________。
(2)探究CO与金属氧化物反应:B处盛某固体物质。Ⅰ 探究氧化还原反应:A处通CO,B处盛Fe2O3粉末,B处下方放酒精喷灯,D处放酒精灯。
实验:在A处通入CO时应立即点燃D酒精灯。在B处高温加热一段时间后,可观察到C处的现象是__________,C处反应的化学方程式为__________。
Ⅱ 探究物质的组成:A处通CO,B处盛某固体混合物,B处下方放酒精喷灯,D处放酒精灯。
已知B处所盛粉末为Fe3O4、CuO、铁粉中的两种或三种物质组成的混合物。
实验:同Ⅰ操作,且在B处高温加热至完全反应,B处可观察到既有红色固体,又有黑色固体。
实验结论(定性):由此现象可知原固体中一定有__________(填化学式)。
定量分析:经测定反应前B处固体质量为30 g,待B处固体完全反应后,测得其质量为22.8 g。将反应后B处固体全部加入到足量的稀硫酸中,完全反应后经过滤、洗涤、干燥,测得剩余固体3.2 g(经查阅资料可知:Fe + H2SO4 =FeSO4 + H2↑,铜和稀硫酸不反应)。
实验结论(定量):原固体中Fe3O4和CuO的质量比:__________(填最简整数比)。
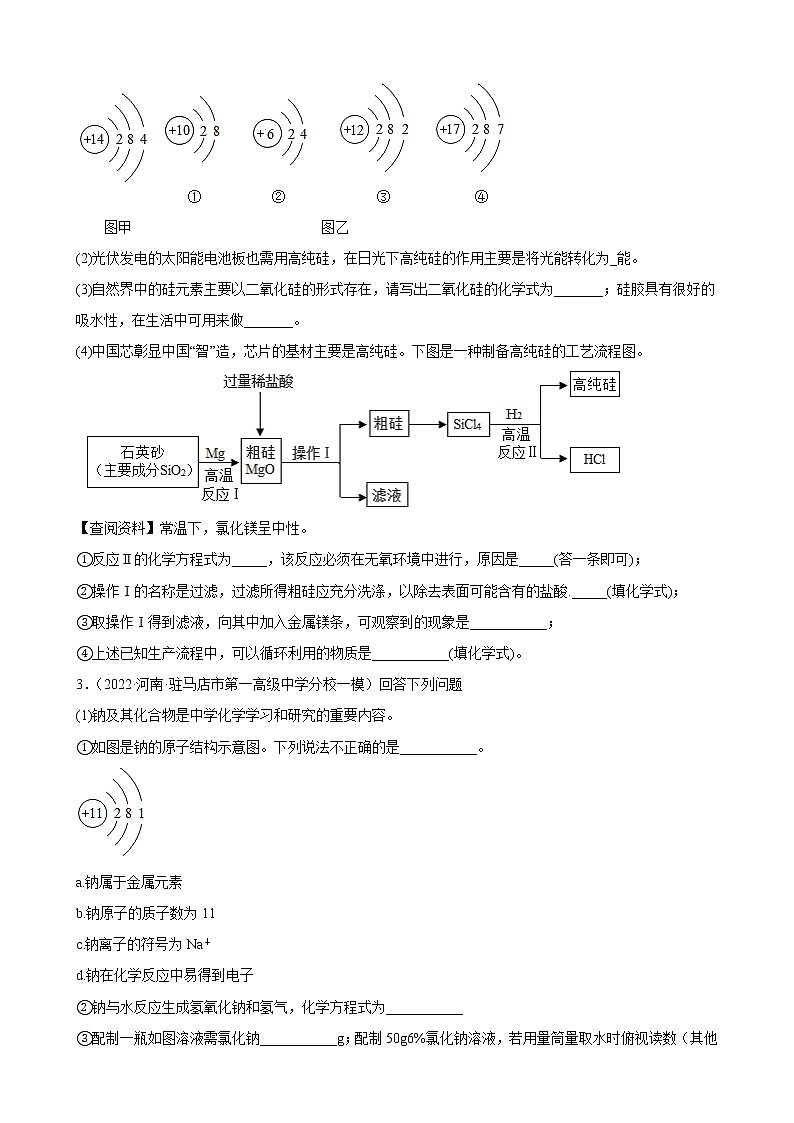
2.(2022·广东·东莞市虎门外语学校九年级阶段练习)中兴缺“芯”事件震惊国人。芯片是电脑.智能家庭等的核心部件,芯片的主要成分是纯度极高的硅,其运算速率与硅的纯度有关。
(1)图甲是硅原子结构示意图,图乙四种粒子的结构示意图中,与硅的化学性质相似的是____(填序号)。
(2)光伏发电的太阳能电池板也需用高纯硅,在日光下高纯硅的作用主要是将光能转化为_能。
(3)自然界中的硅元素主要以二氧化硅的形式存在,请写出二氧化硅的化学式为_______;硅胶具有很好的吸水性,在生活中可用来做_______。
(4)中国芯彰显中国“智”造,芯片的基材主要是高纯硅。下图是一种制备高纯硅的工艺流程图。
【查阅资料】常温下,氯化镁呈中性。
①反应Ⅱ的化学方程式为_____,该反应必须在无氧环境中进行,原因是_____(答一条即可);
②操作Ⅰ的名称是过滤,过滤所得粗硅应充分洗涤,以除去表面可能含有的盐酸._____(填化学式);
③取操作Ⅰ得到滤液,向其中加入金属镁条,可观察到的现象是___________;
④上述已知生产流程中,可以循环利用的物质是___________(填化学式)。
3.(2022·河南·驻马店市第一高级中学分校一模)回答下列问题
(1)钠及其化合物是中学化学学习和研究的重要内容。
①如图是钠的原子结构示意图。下列说法不正确的是___________。
a.钠属于金属元素
b.钠原子的质子数为11
c.钠离子的符号为Na+
d.钠在化学反应中易得到电子
②钠与水反应生成氢氧化钠和氢气,化学方程式为___________
③配制一瓶如图溶液需氯化钠___________g;配制50g6%氯化钠溶液,若用量筒量取水时俯视读数(其他操作正确),则溶液的质量分数___________6%(填“>”、“M,N可以将Fe从其盐溶液中置换出来,故N>Fe,故Fe、Cu、M、N的活动性由强到弱的顺序是N>Fe>M>Cu;
(3)
①Cu2(OH)2CO3与稀硫酸反应生成硫酸铜、水和二氧化碳,故无色气体A是二氧化碳,其化学式写作:CO2;
②蓝色溶液B为硫酸铜,铁和硫酸铜反应生成铜和硫酸亚铁,其化学方程式为:;
③试剂E的目的是去除过量的铁粉,铁的活动顺序在氢之前,因此试剂E可选用稀盐酸溶液;
(4)
根据题意,设家用汽车耗油量为1,则公交车耗油量为5,家用汽车的人均耗油量为,公交车的人均耗油量为,家用汽车的人均耗油量是公交车的5倍,故我的建议是:发展公共交通。
10.(1)增大接触面积,加快溶解的速度
(2)Na2SO4+CNa2S+4CO
(3)生成有害气体,污染空气
(4)二氧化碳##CO2
(5) 向上层清液(或上层溶液)中滴加氯化钙溶液,无沉淀生成,所加氯化钙溶液已足量 硝酸银溶液 解:参加反应的碳酸钠的质量为x
纯碱样品中Na2CO3的质量分数是
答:纯碱样品中Na2CO3的质量分数是88.3%。
【解析】(1)
水浸后分离得到碳酸钠溶液和硫化钙残渣,所以水浸的目的是溶解碳酸钠。搅拌可以加速溶解,所以搅拌的目的是增大接触面积,加快溶解的速度。
(2)
反应物是硫酸钠和碳,生成物是硫化钠和一氧化碳,反应条件是高温,化学方程式为Na2SO4+CNa2S+4CO。
(3)
过程中有一氧化碳、氯化氢等有害气体生成,所以不足有生成有害气体,污染空气。
(4)
从化学方程式可知,二氧化碳即参与反应又有生成,可以循环回收利用。
(5)
①氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,如加入氯化钙已足量,则溶液中不含有碳酸钠,继续加入氯化钙不会有沉淀出现。所以操作是:向上层清液(或上层溶液)中滴加氯化钙溶液,无沉淀生成,所加氯化钙溶液已足量。
②沉淀为碳酸钙,可能表面残留氯化钙、氯化钠等物质。可用硝酸银检验洗涤液中是否含有氯离子,银离子和氯离子结合会形成氯化银沉淀。如加入硝酸银无沉淀生成,说明洗涤干净。
③见答案。
11.(1)导电
(2)放热
(3)H、O
(4)C
(5)
【解析】(1)
高铁上的电刷需要能够导电,用石墨做电刷是利用其导电性,故填导电;
(2)
由题可知,该反应发生后,不需要再持续加热就可保持高温继续进行,说明该反应过程放热,使其温度能够达到反应条件。故填放热;
(3)
电解水的过程中水分子被拆解形成氧原子和氢原子,然后重新组合成新分子氢分子和氧分子,该过程中不发生变化的粒子为氢原子和氧原子,故填H、O;
(4)
除去CO2中混有的少量CO气体,因为CO浓度低,无法点燃,故A错误;
二氧化碳能和澄清石灰石反应,一氧化碳不与石灰水反应,和混合气体通入澄清石灰水中时二氧化碳被吸收,和目的相悖,故B错误;
CO具有还原性,能够和氧化铜高温反应生成二氧化碳和铜,二氧化碳和氧化铜不反应,可以除去CO,故C正确,故选C;
(5)
由流程图可知,反应物为H2、N2和SiCl4,,生成物为Si3N4和HCl,反应条件为高温,根据化学方程式的书写规则,该反应的化学方程式为。
12.(1) c
(2) 13.2 g ab##ba
(3)
bc##cb 解:设碱样品中碳酸钠的质量为x,氢氧化钠的质量为y。
溶质质量分数为5%的稀盐酸365 g中溶质的质量为:
x=0.106 g
y=20 g
碳酸钠的质量分数为:
氢氧化钠的质量分数为:
所以该碱样品的等级是一等品。
【解析】(1)
①从“海水→粗盐→精盐”的过程中,需要涉及到的实验操作有溶解、过滤、蒸发,但不需要洗气,因为这个过程中没有气体;
②因为加入除杂的四种试剂均过量,所以碳酸钠除了能除尽粗盐中的含有CaCl2外,还可把过量的未反应的氯化钡除去,即碳酸钠溶液与氯化钡溶液反应,生成碳酸钡沉淀和氯化钠,该反应的化学方程式为;
(2)
由于温度相同,所以氯化钠的溶解度相同,溶质的质量分数也相同,设:需要NaCl的质量为x,则,;
a、正确称量时,氯化钠的质量=砝码与游码的质量之和,氯化钠与砝码的位置放反了,会导致称量的氯化钠的质量=砝码与游码的质量之差,即称量的实际质量减少了,所以会导致配得的NaCl溶液溶质质量分数偏小,故符合题意;
b、用量筒量水时,仰视凹液面的最低处读数,量取的实际体积偏大,所以会导致配得的NaCl溶液溶质质量分数偏小,故符合题意;
c、溶液具有均一性,各部分溶质的质量分数相同,所以有液体溅出,溶质的质量分数不变,故不符合题意。
故答案为:13.2 g;ab;
(3)
①饱和食盐水通电时有氯气和氢气及氢氧化钠生成,根据质量守恒定律,反应物一定有水参与,根据化学方程式书写原则书写即可;故答案为:;
②a、氢氧化钠和碳酸钠溶液都是碱性的,都能使酚酞变红,所以无法检验碱样品中是否含有Na2CO3,故不符合题意;
b、稀盐酸先与氢氧化钠反应,无明显现象,再与碳酸钠溶液反应,生成氯化钠,水和二氧化碳,有气泡产生,则样品中含有碳酸钠,无气泡产生,则样品中不含碳酸钠,故符合题意;
c、澄清石灰水与碳酸钠反应,生成碳酸钙沉淀和氢氧化钠,即有沉淀生成,则样品中含有碳酸钠,无沉淀生成,则样品中不含碳酸钠,故符合题意。
故选bc。
③见答案。
13.(1)高
(2) Fe+CuSO4=FeSO4+Cu Mg2+、Cu2+
(3)解:参加反应的纯硫酸的质量=100g×19.6%=19.6g
设合金中锌的质量为x
=
x=13g
合金中铜的质量=20g−13g=7g
铜锌合金中铜的质量分数=×100%=35%
答:铜锌合金中铜的质量分数为35%。
【解析】(1)
一般情况下,合金的硬度比纯金属大,则铝合金的强度和硬度比纯铝高;
(2)
石胆“能化铁为铜”是铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
根据金属活动性顺序可知,金属的活动性是:镁>铜>银,向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,镁先与硝酸银反应生成了生成了硝酸镁和银,当硝酸银完全反应后再与硝酸铜反应生成了硝酸镁和铜,充分反应后过滤,滤液呈蓝色,说明了镁已完全反应,溶液中还含有硝酸铜,则滤出的滤液中一定含有金属离子是:Mg2+、Cu2+;
(3)
见答案。
14.(1) C Fe2O3 Cu
(2)
(3)Fe+CuSO4=FeSO4+Cu
(4)Mg##镁
(5) 锌 反应速率适中
【分析】A是黑色固体单质,B是红棕色粉末,结合反应条件高温可知,A是碳单质,B是氧化铁,反应Ⅰ是碳还原氧化铁,C是二氧化碳,D是铁;G是紫红色固体单质,故G是铜;由C+A可生成E可知,E是一氧化碳,E与F可生成铜,则F是氧化铜。
(1)
由分析可知,A是碳(C),B是氧化铁 (Fe2O3),G是铜(Cu);
(2)
反应Ⅱ是C与二氧化碳在高温条件生成一氧化碳,反应的化学方程式为;
(3)
反应Ⅲ是铁与硫酸铜反应,生成铜和硫酸亚铁,反应的化学方程式为:;
(4)
金属与盐酸反应,气泡产生的速率越快,反应越剧烈,图中Mg产生气泡的速率最快,与盐酸反应最剧烈;
(5)
虽然镁、铁与盐酸反应也产生氢气,但是镁产生氢气的速率过于剧烈,而铁又较慢,不利于气体的收集,故应选择产生气体速率适中的锌。
15. 分液漏斗 e f c A、D 排出装置内的空气,以防发生爆炸,也避免影响实验结果
【详解】(1)由图示可知,仪器甲为分液漏斗,故填分液漏斗;
(2)装置B为固液不加热装置,可用于过氧化氢和二氧化锰制取氧气,方程式为 ;
要收集干燥的氧气,需要对产生的氧气进行浓硫酸干燥处理再用向上排空气法收集,故连接口顺序为befc,故填e;f;c;
(3)加热无水醋酸钠和碱石灰的固体混合物的方法来制取甲烷,则发生装置选择固体加热型装置,故发生装置选A;甲烷是密度小于空气且难溶于水的气体,故收集方式可选排水集气法,故选D;故填A、D ;
【实验现象与结论】通入甲烷加热一段时间后才观察到A装置中黑色固体变为红色,说明有铜单质生成;B装置中无水硫酸铜变为蓝色,说明有水生成;C装置中氢氧化钙溶液变浑浊,说明有二氧化碳生成。故甲烷和氧化铜再加热条件下反应生成铜、二氧化碳和水,故方程式为 ;
【反思与评价】甲烷气体具有可燃性,可燃性气体在进行加热或点燃实验前需要保证可燃性气体的纯度,装置中含有空气,通入甲烷加热时容易引起爆炸。氮气性质稳定,不容易和别的物质发生反应,故需要提前通入氮气排出装置中的空气,也避免空气中的二氧化碳影响实验结果。故填排出装置内的空气,以防发生爆炸,也避免影响实验结果。
16.(1)盐
(2)2:1
(3)4s
(4)6.6g
(5)解:设充分反应后,所得硫酸钠的质量为x
答:充分反应后,所得硫酸钠的质量为10.65g。
【解析】(1)
碳酸氢钠是由钠离子和碳酸氢根离子构成的,属于盐类;
(2)
硫酸的化学式为H2SO4,在水中解离为氢离子和硫酸根离子,故可知硫酸溶液中 H+和的数目之比为2:1;
(3)
根据图示可知,当反应时间为4s时,烧杯连同药品的总质量不再发生改变,故反应结束所需时间约为4s;
(4)
根据题目信息可知,烧杯连同药品的起始质量为200g,反应结束后质量变为193.4g,减少的质量为生成二氧化碳的质量,故生成的二氧化碳的质量为:200g-193.4g=6.6g;
(5)
见答案。
17.(1)CO
(2)
(3)CH3COOH##HNO3##H2CO3
(4)
(5)CD
【解析】(1)
一氧化碳容易使人中毒,其化学式为:CO;
(2)
氨水是液态,可以作为氮肥,其化学式为:;
(3)
硝酸是一种酸,其化学式为:HNO3,碳酸也是一种酸,其化学式为:H2CO3;醋酸也是一种酸,其化学式为:CH3COOH;
(4)
天然气的主要成分是CH4,甲烷在空气中燃烧生成水和二氧化碳,反应的化学方程式为:;
(5)
A、若甲是Fe3O4,则乙是Fe,是因为高温条件下四氧化三铁和氢气(或与碳)反应生成铁和水(或生成铁和二氧化碳),和一氧化碳反应生成铁和二氧化碳,铁在氧气中燃烧生成四氧化三铁,故选项说法正确;
B、由A中分析可知,乙是金属铁,单质可以是碳、氧化物,可以是碳、一氧化碳,碳和一氧化碳中都含有碳元素,故选项说法正确;
C、若甲的相对分子质量比乙小16,则甲、乙不一定分别是H2和H2O,甲可能是一氧化碳,乙可能是二氧化碳,一氧化碳与氧气反应生成二氧化碳,与氧化铜反应生成铜和二氧化碳,二氧化碳与碳在高温下反应生成一氧化碳,故选项说法错误;
D、若甲是氧化物,反应①可能是高温条件下四氧化三铁和氢气反应生成铁和水,属于置换反应;反应③是铁在氧气中燃烧生成四氧化三铁,属于化合反应;反应①和③的基本反应类型不一定相同,故选项说法错误,故选:CD。
18.(1)碳原子的排列方式不同
(2) 水蒸气 ③②③① 检验生成的CO2已被除尽,以防影响后续CO的检验 没有进行尾气处理
(3)设用此法生产300t尿素,理论上可固定CO2的质量为x,
x=220t。
【解析】(1)
金刚石和石墨化学性质相似,物理性质差异很大,原因是:碳原子排列方式不同;
(2)
乙醇汽油中含有碳、氢、氧三种元素,根据质量守恒定律可知:乙醇汽油不完全燃烧的产物可能含有CO、CO2和水蒸气;
Ⅰ.根据题意可知:应先检验是否有二氧化碳、再除去二氧化碳、再检验二氧化碳是否被除净,最后除去水蒸气,故A、B、C、D中的试剂依次为③②③①;所以C装置的作用是检验生成的CO2已被除尽,以防影响后续CO的检验;
Ⅱ、若乙醇燃烧生成了一氧化碳,一氧化碳有毒,直接排放会污染空气,故该实验装置存在的缺陷是缺少尾气处理装置;
(3)
见答案。
相关试卷
这是一份2023届中考化学二轮专题复习综合应用题,共23页。试卷主要包含了酸、碱、盐是生活中常见的化合物,填空等内容,欢迎下载使用。
这是一份2023年中考化学一轮专题训练—综合应用题附答案,共27页。试卷主要包含了,如图所示,科学探究是学习化学的重要方法,金属材料的应用推动了社会的发展,回答有关燃料的问题,化学是一门以实验为基础的科学等内容,欢迎下载使用。
这是一份2022年中考化学专题复习综合应用题,共18页。试卷主要包含了实验是学习化学的一条重要途径,我国食盐价格放开,促进盐业改革等内容,欢迎下载使用。








