




所属成套资源:新人教版化学选择性必修1PPT课件全册
- 第二章第一节 化学反应速率(第二课时) 课件 课件 5 次下载
- 第二章第三节 化学反应进行的方向课件 课件 5 次下载
- 3.1.1 强弱电解质课件 课件 5 次下载
- 3.1.3 电离平衡常数课件 课件 5 次下载
- 3.2.1 水的电离课件 课件 6 次下载
第二章第四节 化学反应的调控课件
展开
这是一份第二章第四节 化学反应的调控课件,共18页。
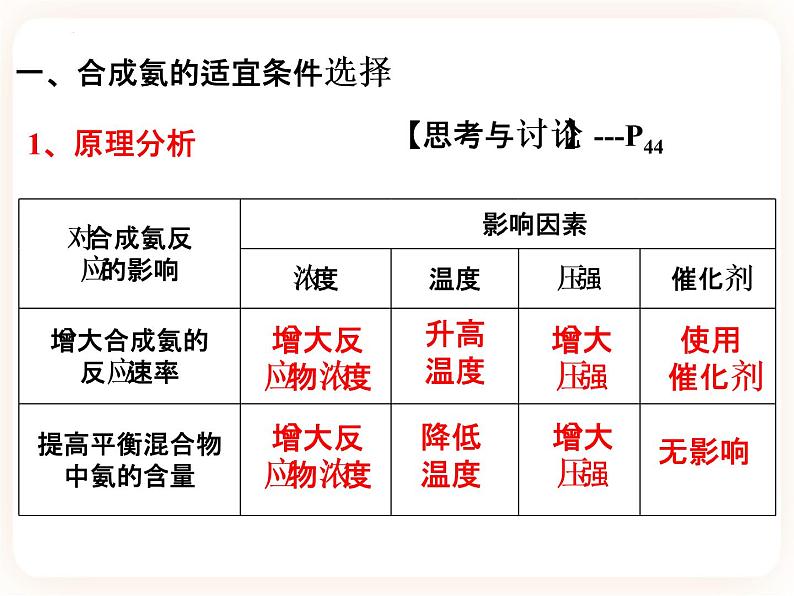
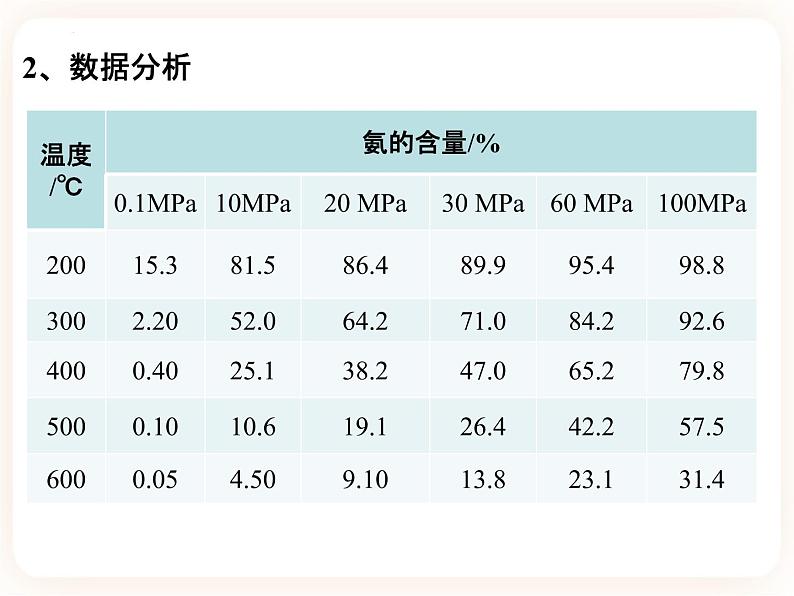
人教版 高中化学 必修一第二章 化学反应速率和化学平衡第四节 化学反应的调控【学习目标】1、了解如何应用化学反应速率和化学平衡原理分析合成氨的适宜条件;2、了解应用化学反应原理分析化工生产条件的思路和方法,体验实际生产条件的选择与理论分析的差异;3、认识化学反应速率和化学平衡的调控在工业生产中的重要作用。工业生产中应该考虑那些问题呢? 以工业合成氨生产条件的选择为例,研究化学反应的调控问题工业合成氨的反应及其特点:(1) 可逆反应。(2)正反应为气体体积_________的反应。(3)正反应为放热反应。减 小1、原理分析增大反应物浓度增大反应物浓度升高温度降低温度增大压强增大压强使用催化剂无影响一、合成氨的适宜条件选择【思考与讨论】---P442、数据分析3、结论: ① 升高温度,氨的含量________;这与反应速率是_______的。 ② 增大压强,氨的含量________;这与反应速率是__________的。降低相矛盾增大相一致二、实际化工生产适宜条件的选择1、分析反应的特点2、 综合考虑影响化学反应速率和化学平衡的因素,同时结合化工生产的动力、材料、设备、催化剂活性等因素实行生产。3、实际生产条件的选择① 压强:合成氨时压强越大越好,但压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。 目前,我国的合成氨厂一般采用的压强为10~30MPa。②温度:低温能提高平衡转化率,但会使化学反应速率 ,达到平衡所需时间变长,这在工业生产中是很不经济的。 目前,在实际生产中一般采用的温度为400~500℃。减小③催化剂:即使在高温、高压下,合成氨反应仍然进行得十分缓慢。 目前工业普遍使用铁触媒催化剂,改变反应历程,降低反应的_________,使反应物在较低温度时能较快地进行反应。该催化剂在500 ℃左右时的活性最大。这也是合成氨反应一般选择400-500 ℃进行的重要原因。另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。活化能④浓度:a. 采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去,以促使化学平衡向___________的方向移动。b. 将氨分离后的原料气循环使用,并及时补充氮气和氢气,使反应物保持一定的浓度,以利于合成氨反应生成NH33、化学反应的调控① 含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。② 考虑实际因素:结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找合适的生产条件;根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。【课堂小结】1、在合成氨工业中,人们常采取一些措施来增加NH3的日产量。在实现此目的的过程中与平衡移动无关的是 ( ) A. 不断将氨分离出来 B. 使用催化剂 C. 采用500 ℃左右的高温而不是700 ℃左右的高温 D. 采用10~30 MPa的压强B课堂练习2、下列有关合成氨工业的说法中正确的是 ( ) A. 铁触媒做催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 B. 升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 C. 增大压强能缩短达到平衡状态所用的时间 D. 合成氨采用的压强是10~30 MPa,因为该压强下铁触媒的活性最高C3、1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是 ( ) A.①②③ B.②④⑤ C.①③⑤ D.②③④B4、某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是 ( )CA.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJB.平衡状态由A变为B时,平衡常数K(A)





