资料中包含下列文件,点击文件名可预览资料内容



还剩9页未读,
继续阅读
成套系列资料,整套一键下载
第一章 原子结构与性质-【知识手册】高中化学全册必背章节知识清单(人教版2019选择性必修2)
展开
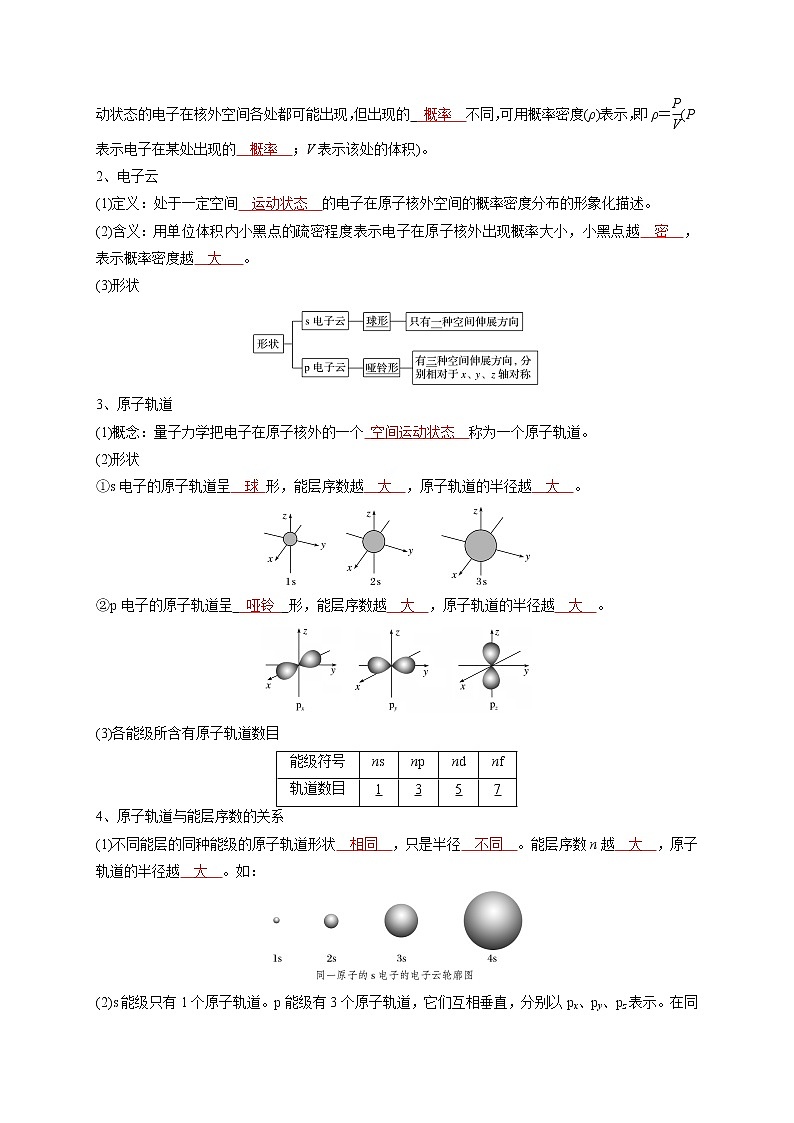
第一章 原子结构与性质第一节 原子结构一、能层与能级1、能层(1)含义:根据核外电子的___________不同,将核外电子分为不同的能层(电子层)。(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用K、L、M、N、O、P、Q……表示,其中每层所容纳的电子数最多为___________个。(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为___________<E(L)<___________<E(N)<E(O)<E(P) ___________。2、能级(1)含义:根据多电子原子的同一能层的电子的___________也可能不同,将它们分为不同___________。(2)表示方法:分别用相应能层的___________和字母s、p、d、f等表示,如n能层的能级按能量由___________到___________的排列顺序为ns、np、nd、nf等。3、能层、能级与最多容纳的电子数由上表可知:(1)能层序数___________该能层所包含的能级数,如第三能层有___________个能级。(2)s、p、d、f 各能级可容纳的最多电子数分别为________、_________、________、________的2倍。(3)原子核外电子的每一能层最多可容纳的电子数是___________ (n为能层的序数)。二、基态与激发态 原子光谱1、基态原子与激发态原子(1)基态原子:处于___________状态的原子。(2)激发态原子:基态原子___________能量,它的电子会跃迁到___________能级,变成___________态原子。2、光谱(1)光谱的成因及分类(2)光谱分析:在现代化学中,常利用原子光谱上的___________来鉴定元素,称为光谱分析。三、构造原理与电子排布式1、构造原理(1)含义以___________事实为基础,从氢开始,随核电荷数递增,新增电子填入___________的顺序称为构造原理。(2)示意图2、电子排布式将___________上所容纳的电子数标在该能级符号___________,并按照能层从左到右的顺序排列的式子。如氮原子的电子排布式为:例:根据构造原理,写出下列基态原子的核外电子排布式①2He:___________;②8O:___________;③10Ne:___________;④14Si:___________;⑤18Ar:___________;⑥19K:___________;⑦21Sc:___________;⑧26Fe:___________。四、电子云与原子轨道1、概率密度1913年,___________提出氢原子模型,电子在___________上绕核运行。量子力学指出,一定空间运动状态的电子在核外空间各处都可能出现,但出现的___________不同,可用概率密度(ρ)表示,即ρ=eq \f(P,V)(P表示电子在某处出现的___________;V表示该处的体积)。2、电子云(1)定义:处于一定空间___________的电子在原子核外空间的概率密度分布的形象化描述。(2)含义:用单位体积内小黑点的疏密程度表示电子在原子核外出现概率大小,小黑点越___________,表示概率密度越___________。(3)形状3、原子轨道(1)概念:量子力学把电子在原子核外的一个___________称为一个原子轨道。(2)形状①s电子的原子轨道呈___________形,能层序数越___________,原子轨道的半径越___________。②p电子的原子轨道呈___________形,能层序数越___________,原子轨道的半径越___________。(3)各能级所含有原子轨道数目4、原子轨道与能层序数的关系(1)不同能层的同种能级的原子轨道形状___________,只是半径___________。能层序数n越___________,原子轨道的半径越___________。如:(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量___________。(3)原子轨道数与能层序数(n)的关系:原子轨道数目=___________。五、泡利原理、洪特规则、能量最低原理(一)原子核外电子的排布规则1、泡利原理:在一个原子轨道里,最多只能容纳___________个电子,它们的自旋___________,常用上下箭头(↑和↓)表示自旋相反的___________。2、电子排布的轨道表示式(电子排布图)8O的轨道表示式如下:例:根据上面回答下列问题:(1)简并轨道:___________相同的原子轨道。(2)电子对:同一个原子轨道中,自旋方向___________的一对电子。(3)单电子:___________轨道中若只有一个电子,则该电子称为单电子。(4)自旋平行:___________的单电子称为自旋平行。(5)在氧原子中,有___________对电子对,有___________个单电子。(6)在氧原子中,有___________种空间运动状态,有___________种运动状态不同的电子。3、洪特规则(1)内容:基态原子中,填入___________的电子总是先单独分占,且自旋平行。(2)特例:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有___________的能量和___________的稳定性。相对稳定的状态eq \b\lc\{\rc\ (\a\vs4\al\co1(全充满:p6、d10、f14,全空:p0、d0、f0,半充满:p3、d5、f7))如:24Cr的电子排布式为___________ ,为半充满状态,易错写为1s22s22p63s23p63d44s2。4、能量最低原理(1)内容:在构建基态原子时,电子将尽可能地占据___________的原子轨道,使整个原子的能量最___________。(2)因素:整个原子的能量由___________、___________和___________三个因素共同决定。注意:书写轨道表示式时,常出现的错误及正确书写(二)核外电子的表示方法电子排布式与轨道表示式的比较 熟记第四周期未成对电子数规律第二节 原子结构与元素的性质一、原子结构与元素周期表(一)元素周期律、元素周期系和元素周期表1、元素周期律:元素的性质随元素原子的___________递增发生___________递变。2、元素周期系:元素按其原子___________递增排列的序列。3、元素周期表:___________的表格,元素周期系只有一个,元素周期表多种多样。4、三张有重要历史意义的周期表(1)门捷列夫周期表:门捷列夫周期表又称___________周期表,重要特征是从第___________周期开始每个周期截成___________截,第___________族分___________族,第___________族称为过渡元素。(2)维尔纳周期表维尔纳周期表是___________,每个周期一行,各族元素、过渡金属、稀有气体、镧系和锕系,各有各的位置,同族元素___________,它确定了前___________个周期的元素种类。(3)玻尔元素周期表玻尔元素周期表特别重要之处是把21~28、39~46等元素用___________框起,这说明他已经认识到,这些框内元素的原子新增加的___________是填入___________的,他已经用原子结构解释元素周期系了,玻尔元素周期表确定了第___________周期为___________种元素。(二)构造原理与元素周期表1、元素周期表的基本结构(1)周期元素种数的确定第一周期从___________开始,以___________结束,只有两种元素。其余各周期总是从___________能级开始,以___________结束,从ns能级开始以np结束递增的___________ (或电子数)就等于每个周期里的元素数目。(2)元素周期表的形成若以一个方格代表一种元素,每个_______排一个横排,并按s、p、d、f分段,左侧对齐,可得到如下元素周期表:若将p段与p段对齐,d段与d段对齐、f段单独列出,将_______与p段末端对齐,则得到书末的元素周期表:2、元素周期表探究(1)元素周期表的结构元素周期表eq \b\lc\{\rc\ (\a\vs4\al\co1(周期:7个共7个横行\b\lc\{\rc\ (\a\vs4\al\co1(短周期:3个第一、二、三周期,长周期:4个第四、五、六、七周期)),族:16个共18个纵列\b\lc\{\rc\ (\a\vs4\al\co1(主族:7个ⅠA~ⅦA族,副族:7个ⅢB~ⅦB族,ⅠB~ⅡB族,Ⅷ族:1个第8、9、10纵列,0族:1个稀有气体元素))))(2)元素周期表的分区①根据核外电子的排布分区按电子排布式中最后填入电子的_______符号可将元素周期表分为s、p、d、f 4个区,而ⅠB、ⅡB族这2个纵行的元素的核外电子因先填满了_______能级而后再填充ns能级而得名_______区。5个区的位置关系如下图所示。②根据元素的金属性和非金属性分区3、元素的对角线规则(1)在元素周期表中,某些_______族元素与其右下方的_______族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为“_______”。(2)处于“对角线”位置的元素,它们的_______具有相似性。实例分析:①锂和镁的相似性A、锂与镁的沸点较为接近:B、锂和镁在氧气中_______时只生成对应的氧化物,并且Li2O和MgO与水反应都十分缓慢。4Li+O2eq \o(=====,\s\up7(点燃))2Li2O、2Mg+O2eq \o(=====,\s\up7(点燃))2MgO。C、锂和镁与水的反应都十分缓慢,并且生成的氢氧化物_______溶于水,附着于金属表面阻碍反应的进行。D、锂和镁都能直接与氮气反应生成相应的氮化物Li3N和Mg3N2。E、锂和镁的氢氧化物在加热时,可分解为Li2O、H2O和MgO、H2O。F、在碱金属的氟化物、碳酸盐和磷酸盐中,只有锂盐是_______溶于水的,相应的镁盐也_______溶于水。②铍和铝的相似性A、铍与铝都可与酸、碱反应放出_______,并且铍在浓硝酸中也发生_______化。B、二者的氧化物和氢氧化物都既能溶于强酸又能溶于强碱溶液:Al(OH)3+3HCl===______________,Al(OH)3+NaOH===______________;Be(OH)2+2HCl===______________,Be(OH)2+2NaOH===______________。C、二者的氧化物Al2O3和BeO的熔点和硬度都很高。D、BeCl2和AlCl3都是共价化合物,易_______。③硼和硅的相似性A、自然界中B与Si均以化合物的形式存在。B、B与Si的单质都易与强碱反应,且不与稀酸反应:2B+2KOH+2H2O===______________,Si+2KOH+H2O===______________。C、硼烷和硅烷的稳定性都比较差,且都易______________。D、硼和硅的卤化物的熔、沸点比较低,易挥发,易水解。解题技巧:根据原子结构特征判断元素在元素周期表中的位置电子排布式eq \o(――→,\s\up7(确定))价电子排布式eq \o(――→,\s\up7(确定))二、元素周期律(一)原子半径1、影响原子半径大小的因素(1)电子的能层数:电子的能层越多,电子之间的_______作用使原子半径_______。(2)核电荷数:核电荷数越_______,核对电子的吸引作用就越_______,使原子半径_______。2、原子半径的递变规律(1)同周期:从左至右,核电荷数越_______,半径越_______。(2)同主族:从上到下,核电荷数越_______,半径越_______。3、原子或离子半径的比较方法(1)同种元素的离子半径:阴离子_______于原子,原子_______于阳离子,低价阳离子_______于高价阳离子。例如:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。(2)能层结构相同的离子:核电荷数越______________,半径越______________。例如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。(3)带相同电荷的离子:能层数越______________,半径越______________。例如:r(Li+)<r(Na+)<r(K+) _______r(Rb+)<r(Cs+),r(O2-)<r(S2-) _______ (Se2-)<r(Te2-)。(4)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+) _______r(Na+) _______r(Mg2+)。解题技巧:粒子半径比较的一般思路(1)“一层”:先看能层数,能层数越_______,一般微粒半径越_______。(2)“二核”:若能层数相同,则看核电荷数,核电荷数越_______,微粒半径越_______。(3)“三电子”:若能层数、核电荷数均相同,则看核外电子数,电子数_______的半径_______。(二)元素的电离能1、元素第一电离能的概念与意义(1)概念①第一电离能:_______电中性_______原子失去一个电子转化为______________正离子所需要的______________叫做第一电离能,符号:_______。②逐级电离能:气态基态_______价正离子再_______一个电子成为气态基态_______价正离子所需的最低能量叫做第二电离能,第三电离能和第四、第五电离能依此类推。由于原子失去电子形成离子后,若再失去电子会更加_______,因此同一原子的各级电离能之间存在如下关系:I1
相关资料
更多









